
Биофотолиз воды в модельных системах с низкомолекулярными переносчиками электронов
Реакция фоторазложения воды на водород и кислород проводилась по схеме [150, 447, 459]
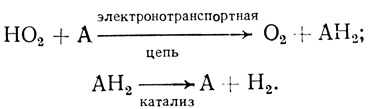 (3.6)
(3.6)При этом использовалась возможность фотовосстановления экзогенодобавленных акцепторов электрона с участием электронотранспортной цепи изолированных хлоропластов. Создание таких систем представляется перспективным по двум причинам:
1. При условии, что перенос электронов из электронотранспортной цепи фотосинтеза на медиатор А протекает по бимолекулярному механизму, концентрацией медиатора можно регулировать скорость электронотранспортных процессов и в пределе направить весь электронный поток на восстановление медиатора. Это может служить одним из подходов к достижению наивысшего КПД систем.
2. Реализация двухстадийных в макроскопическом смысле процессов (см. схему 3.6) позволяет в принципе осуществить разделение водорода и кислорода, поскольку газы выделяются на различных стадиях.
Переносчик электрона А должен удовлетворять ряду кинетических и термодинамических требований: 1) быть акцептором электронов из электронотранспортной цепи фотосинтеза; 2) окислительно-восстановительный потенциал пары окисленный - восстановленный медиатор должен быть близок к окислительно-восстановительному потенциалу водорода; 3) должна существовать возможность каталитического выделения водорода из восстановленной формы медиатора.
Нами исследован широкий круг потенциальных низкомолекулярных медиаторов. Наилучшему соответствию сформулированным выше требованиям отвечают производные γ, γ'-дипиридина (виологеновые красители) и НАД-кофактор, близкий к физиологическому акцептору электронотранспортной цепи. При использовании этих соединений может быть проведена реакция фотолиза воды. Рис. 29 иллюстрирует кинетику накопления водорода в газовой фазе при освещении системы изолированные хлоропласты - метилвиологен - гидрогеназа фототрофных бактерий Т. roseopersicina (данные работы [150]).
![Рис. 29. Типичные кривые фотовыделения водорода в системе хлоропласты - метилвиологен - гидрогеназа [150]. Условия: 0,6 мМ метилвиологена; 2,8% глицерина; 1% этанола; 30 мМ фосфата натрия; 7 мМ хлористого натрия; 25 мкМ БСА; концентрация хлоропластов соответствует 18 мг/л хлорофилла; 0,2 мг/мл гидрогеназы Т. roseopersicina; pH 7,8; 30°С; 1 - исходная система; 2 - в присутствии 3 мкМ диурона; 3 - без освещения; 4 - предварительно прогретые хлоропласты (10 мин, 45°С)](pic/000183.jpg)
Рис. 29. Типичные кривые фотовыделения водорода в системе хлоропласты - метилвиологен - гидрогеназа [150]. Условия: 0,6 мМ метилвиологена; 2,8% глицерина; 1% этанола; 30 мМ фосфата натрия; 7 мМ хлористого натрия; 25 мкМ БСА; концентрация хлоропластов соответствует 18 мг/л хлорофилла; 0,2 мг/мл гидрогеназы Т. roseopersicina; pH 7,8; 30°С; 1 - исходная система; 2 - в присутствии 3 мкМ диурона; 3 - без освещения; 4 - предварительно прогретые хлоропласты (10 мин, 45°С)
Общая схема реакции может быть представлена в виде
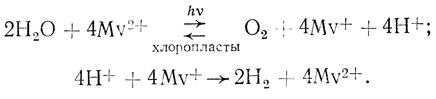 (3.7)
(3.7)На последней стадии образования водорода из восстановленного метилвиологена в качестве катализатора можно использовать металлическую платину [459].
При обсуждении механизма (3.7) и аналогичных механизмов принципиален вопрос об участии системы фоторазложения воды электронотранспортной цепи фотосинтеза. В наших экспериментах участие системы фоторазложения воды доказывалось путем ингибирования реакции диуроном (см. рис. 29). Как известно, диурон специфически блокирует электронный транспорт на уровне фотосистемы II и системы разложения воды.
В работе [447] детально исследованы кинетические закономерности первой стадии процесса - фотовосстановление замещенных γ-γ'-дипиридилов. При освещении раствора метилвиологена с суспензией хлоропластов в вакуумированной спектрофотометрической кювете монохроматическим лазерным светом (λ = 632,8 нм) или концентрированным белым светом наблюдаются характерные спектральные изменения, связанные с одноэлектронным восстановлением метилвиологена. Фотовосстановление метилвиологена не достигает больших глубин, поскольку в системе со временем устанавливается фотостационарное состояние. Фотостационарная концентрация восстановленной формы зависит от интенсивности света, концентрации метилвиологена, концентрации ионов водорода. Экспериментально наблюдаемые зависимости приведены на рис. 30-32.
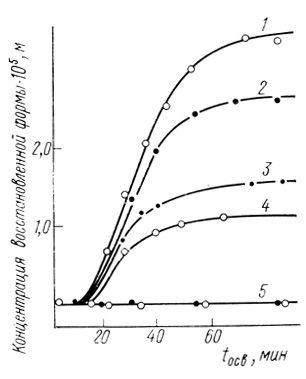
Рис. 30. Кинетические кривые фотовосстановления метилвиологена и бензилвиологена при различных исходных концентрациях. Условия: 3,2% глицерина; 34 мМ фосфата натрия; 9 мМ хлористого натрия; 4 мкМ БСА; концентрация хлоропластов, соответствующая 62 мг/л хлорофилла; pH 7,8; 25°С. Концентрации медиаторов: метилвиологен 1 - 0,4 мМ; 2 - 0,26 мМ; 3 - 0,11 мМ; бензилвиологен 4 - 0,4 мМ; 5 - то же, что и 1 в присутствии 3 мкМ диурона. Освещение лазер ЛГ-56
![Рис. 31. Обратимый характер фотовосстановления метилвиологена с помощью хлоропластов [459]. Стрелками указаны моменты включения и выключения света](pic/000186.jpg)
Рис. 31. Обратимый характер фотовосстановления метилвиологена с помощью хлоропластов [459]. Стрелками указаны моменты включения и выключения света
![Рис. 32. Зависимость кинетики процесса фотовосстановления метилвиологена (А) и его фотостационарные концентрации (Б) от pH. Освещение: лазер ЛГ-56, (25 мВт). Состав реакционной смеси: 10 мМ метилвиологендихлорид; 0,36 мМ сахарозы; 18 мМ фосфата натрия; 9 мМ хлористого натрия; хлоропласты, содержащие 1,4.10-2 мг/мл хлорофилла; 1 - pH 5,9; 2 - pH 6,8; 3 - pH 7,2; 4 - pH 7,5; 5 - pH 8,1; 25°С. Перед освещением кювету вакуумировали [447]](pic/000187.jpg)
Рис. 32. Зависимость кинетики процесса фотовосстановления метилвиологена (А) и его фотостационарные концентрации (Б) от pH. Освещение: лазер ЛГ-56, (25 мВт). Состав реакционной смеси: 10 мМ метилвиологендихлорид; 0,36 мМ сахарозы; 18 мМ фосфата натрия; 9 мМ хлористого натрия; хлоропласты, содержащие 1,4⋅10-2 мг/мл хлорофилла; 1 - pH 5,9; 2 - pH 6,8; 3 - pH 7,2; 4 - pH 7,5; 5 - pH 8,1; 25°С. Перед освещением кювету вакуумировали [447]
Фотохимическая реакция обратима (рис. 31). При этом реакция окисления восстановленной формы метилвиологена имеет порядок больше, чем единица. При исследовании кинетики окисления восстановленной формы метилвиологена в темноте установлено, что процесс достаточно строго описывается кинетической кривой второго порядка. Это указывает на то, что восстановленная форма окисляется веществом, образующимся в строгом стехиометрическом соотношении в результате световой фотохимической реакции.
Фотовосстановление метилвиологена протекает с участием электронотранспортной цепи, причем в этом процессе участвует система разложения воды. Это следует из данных по ингибированию фотовосстановления диуроном.
Проведенное исследование позволило оптимизировать реакцию фотовосстановления замещенных γ, γ'-дипиридилов. В оптимальных условиях pH при больших интенсивностях света степень фотовосстановления метилвиологена может быть достаточно высокой (70-80%).
Проведению стабильной реакции биофотолиза воды существенно препятствует высокая реакционная способность возникающих при восстановлении катион-радикалов в реакции с молекулярным кислородом. В работе [458] исследована кинетика реакции восстановленного метилвиологена с кислородом. Реакция одноэлектронного восстановления кислорода протекает чрезвычайно быстро, практически в диффузионном режиме. Также быстро (k = 2,3⋅103 М-1⋅с-1) протекает реакция восстановления метилвиологеном перекиси водорода. Эти реакции, а также возможные обратные реакции взаимодействия с окисленными переносчиками электронотранспортной цепи приводят к "запределиванию" реакции и существенному уменьшению эффективности конверсии световой энергии.
Принципиальным вопросом является уменьшение скорости обратной окислительной реакции. Из общих соображений в этом плане перспективны переносчики, претерпевающие двухэлектронное окисление-восстановление. Молекулярный кислород в равновесном состоянии представляет собой триплетную, бирадикальную частицу. В силу этого реакции кислорода с радикалами, протекающие с сохранением спина, идут очень быстро.
Нами проведено исследование по выяснению возможности фотовосстановления электронотранспортной цепью хлоропластов никотинамидадениндинуклеотида (НАД+). Восстановленная форма НАДН не окисляется кислородом. В нативном состоянии без добавления ферментов-переносчиков изолированные хлоропласты не способны восстанавливать НАД+. Добавление фермента НАДН-дегидрогеназы из Bacterium sp1 обеспечивает возможность фотовосстановления НАД+ (рис. 33). В этих условиях реакция фотовосстановления протекает с максимальной скоростью 3,5⋅10-6 М/л⋅мин.
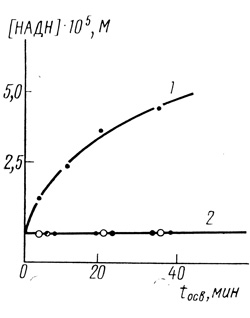
Рис. 33. Фотовосстановление НАД+ в присутствии изолированных хлоропластов и НАДН-дегидрогеназы из Bacterium sp N1. Условия: 7 мМ НАД+; активность НАДН-дегидрогеназы 0,5 мкМ/мин⋅л; 3,7% глицерина; 40 мМ фосфата натрия; 10 мМ хлористого натрия; 3⋅10-5 М БСА; 1 - исходная система при освещении; 2 - система без освещения (●), в отсутствие НАДН1 дегидрогеназы (○), при освещении в отсутствие хлоропластов (¤)
Таким образом, схема биофотолиза воды в этом случае имеет вид:
2НАД+ + 2Н2О → О2 + 2НАДН + 2Н+;
2НАДН + 2Н+ → 2Н2 + 2НАД+. (3.8)
Специфическое дегидрирование НАДН с образованием молекулярного водорода протекает с участием гидрогеназы Al. eutrophus Z = 1, фермента, выделенного и очищенного до гомогенного состояния в нашей лаборатории (см. гл. II).
Использованные в настоящее время системы фоторазложения воды еще не вышли на уровень технологического освоения, этому препятствуют два основных обстоятельства.
1. Коэффициенты преобразования энергии еще не достаточно высоки. Для систем на основе хлоропласт-ферредоксин-гидрогеназа [393] или хлоропласт-медиатор-гидрогеназа [158] эта величина меньше одного процента, что достаточно далеко от теоретического предела. Причина, вероятно, в недостаточно хорошем сопряжении электронотранспортных процессов с системой образования водорода. В этом плане биофотолитические системы имеют определенный потенциал развития. В принципе перенос электронов от воды на искусственные акцепторы может быть проведен достаточно эффективно и приближаться к теоретическому пределу [459]. Для повышения КПД систем предстоит проделать еще значительную работу по оптимизации процесса выделения водорода.
2. Исследованные системы обладают сравнительно невысокой устойчивостью. Нами детально исследован механизм инактивации электронотранспортной цепи хлоропластов и разработаны способы иммобилизации и стабилизации функционирующих цепей. Однако наиболее перспективны высоковозобновляемые системы на основе микроорганизмов.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'