
Иммобилизация и стабилизация электронотранспортной цепи хлоропластов
В работах [511, 514] исследовано влияние различных факторов среды и иммобилизации на процесс необратимой инактивации, характеризуемый константой λ2, с целью изучения возможности значительной стабилизации электронотранспортной цепи.
Следует различать внешнюю и внутреннюю иммобилизацию сложных биологических структур, таких как клетки микроорганизмов или органеллы. При внешней иммобилизации органеллы и клетки заключаются в гели и (или) химически "пришиваются" к различным поверхностям, так что они теряют подвижность как целые структурные единицы. При внутренней иммобилизации или фиксации обработка бифункциональными или полифункциональными реагентами приводит к ограничению внутриклеточной или внутриорганельной подвижности белков или биомембран.
По внешней иммобилизации хлоропластов имеется лишь несколько работ. Проведенное в работе Китайема и Батлера [515] микрокапсулирование хлоропластов показало, что в процессе иммобилизации происходит значительная инактивация хлоропластов" и только фотосистема I сохраняет до 30% своей активности. Иммобилизация хлоропластов в полиакриламидные гели понижает активность фотосистемы I и фотосистемы II до 10% [516].
В нашей лаборатории проведено большое число экспериментов по иммобилизации изолированных хлоропластов. Хлоропласты иммобилизовали в полиакриламидный гель различного состава, гель, образуемый при обработке желатины или бычьего сывороточного альбумина глутаровым альдегидом, желатиновый и агар-агаровый гели. В общем случае происходит инактивация хлоропластов, при этом система разложения воды (фотосистема II) инактивируется в первую очередь. Лишь в случае агар-агарового и желатинового гелей удается сохранить достаточную активность обеих фотосистем.
На рис. 51 представлена зависимость скорости фотовосстановления ферроцианид-иона от концентрации субстрата для иммобилизованных и неиммобилизованных хлоропластов. Реакцию проводили при насыщающих интенсивностях света, рН-статически оттитровывая протоны, образующиеся при фотоокислении воды. В случае неиммобилизованных хлоропластов реакция протекает в насыщении по субстрату. Зависимость скорости от концентрации субстрата для иммобилизованных хлоропластов интерпретируется как проявление диффузионного сопротивления массопереносу субстрата [514].
Сравнение pH-зависимости максимальной скорости для иммобилизованных и неиммобилизованных хлоропластов (рис. 52) показывает, что иммобилизация приводит к сдвигу максимума активности на 0,6 единицы в сторону низких значений pH. Подобное смещение pH-профиля в реакции Хилла наблюдали ранее [517, 518] при "старении" и инактивации хлоропластов. В табл. 31 приведена зависимость константы скорости необратимой инактивации иммобилизованных хлоропластов от "жесткости" агар-агарового геля. Видно, что при иммобилизации наблюдается незначительная стабилизация электронотранспортной цепи, при этом хлоропласты наиболее стабильны в более "мягких" гелях.
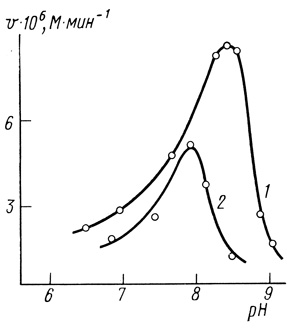
Рис. 52. Влияние pH на активность электронотранспортной цепи изолированных хлоропластов: 1 - нативные хлоропласты; 2 - хлоропласты, иммобилизованные в 3%-ном агар-агаровом геле. Условия: 20% глицерина; 50 мМ хлористого натрия; 22°С; хлоропласты в концентрации, соответствующей 2 мг/л хлорофилла

Таблица 31. Зависимость константы скорости необратимой инактивации электронотранспортной цепи изолированных хлоропластов от концентрации агар-агара в геле
Инактивационные процессы протекают, по-видимому, во внутренней мембране хлоропластов, на которую не оказывает влияния полимерная матрица. В этом плане интересно исследование внутренней иммобилизации хлоропластов.
В литературе имеются исследования качественного характера по изучению влияния бифункциональных реагентов на активность электронотранспортной цепи хлоропластов [519-523].
В рамках кинетической модели (3.103) нами было проведено исследование зависимости величины λ2 от концентрации глутарового альдегида при предварительной обработке хлоропластов и от времени фиксации (рис. 53). Полученные экспериментальные данные позволяют сделать следующие выводы.
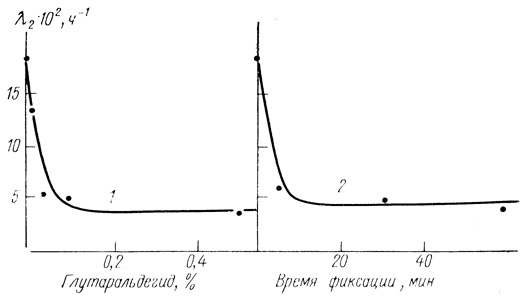
Рис. 53. Стабилизация электронотранспортной цепи изолированных хлоропластов фиксацией глутаровым альдегидом; 1 - зависимость λ2 от концентрации альдегида при времени фиксации 30 мин; 2 - зависимость λ2 от времени обработки хлоропластов 0,2%-ным раствором глутарового альдегида. Условия фиксации: 0,4 М сахароза; 40 мМ фосфата натрия; 10 мМ хлористого натрия; pH 7,8; 22°С; хлоропласты в концентрации, соответствующей 90 мг/л хлорофилла. При исследовании кинетики инактивации хлоропласты инкубировали в том же буфере при 32°С
1. Обработка хлоропластов глутаровым альдегидом существенно инактивирует электронотранспортную цепь, при этом степень ингибирования начальной активности зависит от концентрации фиксирующего агента и продолжительности обработки. Эти данные согласуются с качественными результатами, полученными в работе [521].
2. Обработка хлоропластов глутаровым альдегидом приводит к стабилизации электронотранспортной цепи, уменьшению константы λ2. Как следует из данных рис. 53, увеличение концентрации или времени обработки фиксирующим агентом дает один и тот же предельный эффект стабилизации.
Снижение эффективности процессов электронного транспорта в фиксированных хлоропластах может быть связано как с дезорганизацией в процессе обработки пигментных систем [521], так и с понижением конформационной подвижности реакционных центров за счет образующихся при фиксации сшивок. С другой стороны, ингибирование электронотранспортного процесса можно объяснить непосредственным взаимодействием глутарового альдегида с ферментами - переносчиками электрона [523].
Наиболее значительные эффекты стабилизации электронотранспортной цепи получены при изучении влияния среды на кинетику инактивации хлоропластов. На рис. 54 приведены данные по зависимости параметра от концентрации глицерина в инкубационной среде. Видно, что глицерин заметно стабилизирует электронотранспортную цепь, при этом кривая проходит через минимум; очень высокие концентрации глицерина не влияют на начальную активность хлоропластов, однако заметно ускоряют их инактивацию.
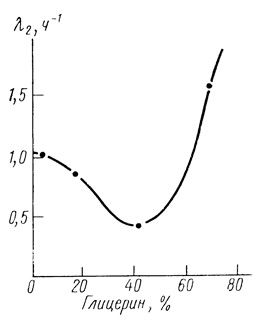
Рис. 54. Стабилизация электронотранспортной цепи хлоропластов глицерином. Зависимость параметра λ2 от концентрации глицерина. Условия инкубации: 40 мМ фосфата натрия; 10 мМ хлористого натрия; pH 7,8; 35°С; хлоропласты в концентрации, соответствующей 80 мг/л хлорофилла
Инертные белки, прежде всего бычий сывороточный альбумин, часто используют в качестве стабилизаторов биологических структур. Нами исследована зависимость кинетики инактивации хлоропластов от концентрации в системе бычьего сывороточного альбумина. Добавление в систему BSA существенно стабилизирует электронотранспортную цепь хлоропластов. На рис. 55 приведена зависимость, которая, как и для глицерина, имеет экстремальный характер. Максимальная стабильность хлоропластов наблюдается при 0,1 мМ альбумина.
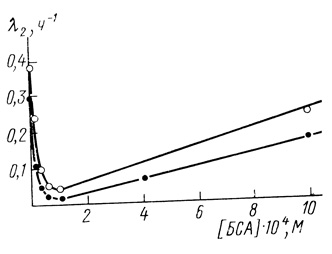
Рис. 55. Стабилизация электронотранспортной цепи хлоропластов альбумином. Зависимость параметра от концентрации бычьего сывороточного альбумина. Условия инкубации хлоропластов: 40% глицерина; 40 мМ фосфата натрия; 10 мМ хлорида натрия; 10 мМ ЭДТА; pH 7,8; 35°С; хлоропласты в концентрации, соответствующей содержанию 110 мг/л хлорофилла
Концентрация ионов водорода - важный фактор, определяющий стабильность биполимерных структур. На рис. 56 приведены pH-профили параметра λ2 для исходных хлоропластов (кривая 1), хлоропластов, стабилизированных оптимальной концентрацией глицерина (кривая 2) и альбумина (кривая 3). Максимум стабильности для всех трех кривых наблюдается около pH 7,0.
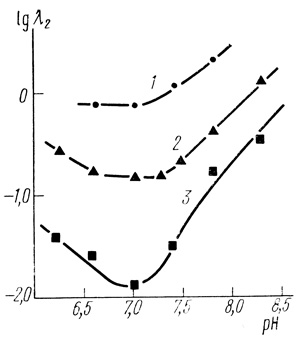
Рис. 56. Зависимость логарифма λ2 от pH (инструментальное значение). Условия инкубации хлоропластов: 40 мМ фосфата натрия; 10 мМ хлорида натрия; 35°С; хлоропласты в концентрации, соответствующей 120 мг/л хлорофилла. 1 - 3,7% глицерина; 2 - 40% глицерина; 3 - 40% глицерина, 0,1 мМ БСА
Таким образом, детальное исследование процесса, ответственного за инактивацию фотосинтетической активности в хлоропластах, показывает, что этот процесс весьма чувствителен к внешним условиям, которые определяются физико-химическими свойствами среды.
Характерной особенностью инактивации хлоропластов является экстремальный характер полученных зависимостей. Один и тот же компонент может быть как стабилизирующим, так и дестабилизирующим фактором в зависимости от его концентрации. Оптимальные условия: pH 7,0; мМ 40 фосфата; 10 мМ ЕДТА; 0,1 мМ БСА; 40% глицерина. В этих условиях среднее время сохранения хлорелл а ста ми активности равно 360 ч (35°С) по сравнению с 2 ч в контрольном опыте.
Было проведено исследование зависимости параметра λ2 от температуры. Наблюдаемая зависимость характеризуется изломом при температуре ∼35°С. Процесс инактивации существенно ускоряется в области температур 35-50°С. Термодинамические характеристики "высокотемпературной" и "низкотемпературной" инактивации соответственно равны: ΔН≠выс = 96 ккал/моль, ΔS≠выс = 231 э. е., ΔН≠низк = 18 ккал/моль, ΔS≠низк = -21 э. е. Существует экспериментальное свидетельство, что при температуре 30°С происходит кооперативный процесс "плавления" мембраны хлоропластов [524]. Это, возможно, один из самых важных факторов, препятствующих дальнейшей стабилизации хлоропластов.
В таблице 32 подведены итоги по исследованию стабильности элементов систем биофотолиза воды. В ней приведены исследованные системы, условия проведения процесса и среднее время работы, которое является общей интегральной характеристикой всех систем (см. уравнение 3.69).

Таблица 32. Средние времена 'жизни' элементов систем биофотолиза воды
Таким образом, в настоящее время разработана кинетическая теория инактивации биокаталитических систем, основанная на представлениях о надежности, развитых для описания "старения" физических систем. На основе использования этой теории проведен анализ кинетики и механизмов инактивации элементов систем биофотолиза воды и разработаны методы их существенной стабилизации.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'