
5. Ферментативное электрохимическое восстановление кислорода
Создание биохимических топливных элементов неразрывно связано с разработкой кислородного электрода, осуществляющего электрохимическое восстановление кислорода. В "классической" электрохимии это одна из наиболее сложных проблем. Известно, что равновесный потенциал окисления-восстановления пары O2/Н2O, равный 1,23 В, устанавливается лишь на предварительно специально обработанной платине и в особо чистых растворах [548, 549]. Токи обмена кислорода на платине весьма малы и составляют 10-11 А/см2.
С другой стороны, существуют ферменты, которые активно восстанавливают кислород по четырехэлектронному механизму до воды без промежуточного образования в растворе перекиси водорода. Таких ферментов не очень много. Это цитохром-С-оксидаза, церулоплазмин, аскорбатоксидаза, лакказа. В рамках биоэлектрокатализа эти ферменты могут рассматриваться как потенциальные катализаторы реакции катодного восстановления кислорода. В работах [526, 550] описаны системы, в которых катализаторами восстановления кислорода служили пероксидаза и цитохром-С-оксидаза. Перенос электронов с электрода на активные центры фермента осуществляли медиаторы. Потенциал электрода, определяемый в этом случае отношением восстановленной и окисленной формы медиатора, составлял величину 0,6-0,8 В, что значительно ниже равновесного кислородного потенциала.
Ниже рассматриваются свойства ферментативного кислородного электрода, основанного на прямом обмене электронов между электродом и активным центром фермента [251, 546]. В качестве катализатора была использована лакказа Poluporos versicolor.
Лакказа является медьсодержащим ферментом, осуществляющим четырехэлектронное восстановление кислорода при использовании в качестве доноров различных ароматических аминов и фенолов. В активный центр фермента входят четыре иона меди, проводящие координированное восстановление кислорода. Лакказа - "типичный" фермент с точки зрения каталитической эффективности, найденное значение kкат = 200 с-1, значение KМ по кислороду равно 10-5 М. Механизм действия лакказы не достаточно ясен, наиболее сложный вопрос заключается в механизме "сложения" четырех электронов из одноэлектронных доноров, необходимых для восстановления кислорода. Современные данные по механизму катализа лакказой приведены в работах [551, 552].
Нами были исследованы возможности электрокаталитического действия лакказы. Как известно, электровосстановление кислорода в нейтральных или слабокислых растворах на углеродных материалах протекает со значительным перенапряжением [553]. Нами обнаружено, что введение в раствор лакказы в незначительных количествах (10-8 М) вызывает существенное смещение стационарного потенциала в область положительных значений и ускорение электровосстановления кислорода.
Электрохимические измерения проводили на электродах из сажи, пирографита, адсорбционным способом непосредственно на электрод, который выдерживали в растворе фермента в течение суток. В табл. 35 приведены значения стационарных потенциалов, полученных на электродах из различных материалов. В присутствии кислорода и лакказы наблюдается увеличение потенциала электрода. Максимальное значение потенциала +1,207 В, близкое к равновесному потенциалу кислородного электрода, устанавливается на электродах из сажи, которые предварительно выдерживали в растворе лакказы (10-5 М) в течение суток.
![Таблица 35. Значения стационарного потенциала (В), устанавливающегося на электродах из различных материалов в отсутствие и в присутствии 4-10-7 М лакказы [251]](pic/000335.jpg)
Таблица 35. Значения стационарного потенциала (В), устанавливающегося на электродах из различных материалов в отсутствие и в присутствии 4⋅10-7 М лакказы [251]
* (Приведены средние значения, взятые по 12 опытам. Отклонения от среднего значения не превышают 15 мВ.)
Адсорбция фермента на электродах из сажи практически необратима. После иммобилизации электрод сохраняет каталитические свойства в отсутствие лакказы в растворе. Ферментативная природа электрокатализа была доказана специфическим ингибированием электрокаталитических эффектов фторид- и азид-ионами, инактивацией прогреванием, сопоставлением рН-зависимости электрокаталитических эффектов и каталитической активности в реакции окисления феррицианид-иона кислородом. На рис. 78 приведены зависимости стационарного потенциала и потенциала при различном токосъеме для сажевого электрода с иммобилизованной лакказой от pH. Поляризационные кривые электрода с различным содержанием фермента даны на рис. 79. Эффект ингибирования электрокаталитических эффектов азид-ионом иллюстрирует рис. 80, на котором приведены поляризационные кривые электрода из сажи, сажевого электрода с иммобилизованным ферментом и ферментного сажевого электрода с иммобилизованным ферментом в присутствии 1 мМ NaN3.
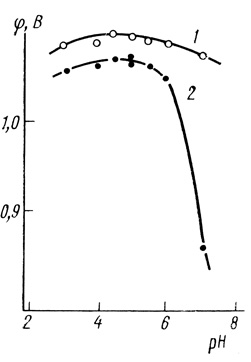
Рис. 78. Зависимость потенциала электрода с иммобилизованной лакказой от pH: 1 - стационарный потенциал (i = 0); 2 - потенциал при i = 17,5 мкА; 25°С; 0,01 М ацетата фосфата натрия
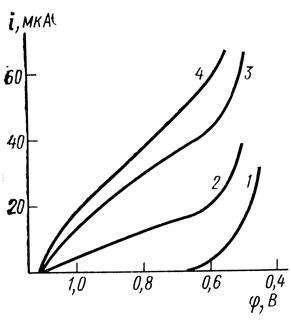
Рис. 79. Потенциостатические поляризационные кривые катодного восстановления кислорода, снятые на вращающемся дисковом электроде из сажи, нанесенной на пирографит. Концентрация лакказы, вводимой в раствор: 1 - 0; 2 - 2⋅10-9 М; 3 - 6⋅10-9 М; 4 - 10-8 М, скорость вращения электрода 610 об/мин
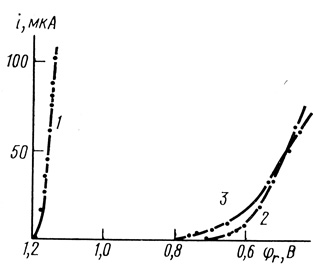
Рис. 80. 1 - Поляризованные кривые, снятые на электроде из сажи с иммобилизованной лакказой в атмосфере кислорода; 2 - контрольный опыт на электроде из сажи без фермента; 3 - электрод из сажи с иммобилизованным ферментом в присутствии 1 мМ NaN3
Экспериментально было обнаружено, что стационарный потенциал электрода зависит от парциального давления кислорода и pH раствора. Для выяснения природы стационарного потенциала, устанавливающегося на электроде с иммобилизованной лакказой, были исследованы зависимости φст от парциального давления кислорода (табл. 36) и pH раствора. Найдено, что ∂φст/∂lgPo2 составляет 10-12 мВ, ∂φст/∂pH составляет 60 мВ. Эти значения близки к коэффициентам в уравнении Нернста для системы О2/Н2О. В специальном эксперименте на вращающемся дисковом электроде было показано, что в случае электрохимического восстановления кислорода иммобилизованной лакказой отсутствует перекись водорода, выделяющаяся в раствор. Исследование системы методом вращающегося диска с кольцом не обнаружило в растворе промежуточной перекиси водорода. Рассмотрение всех имеющихся экспериментальных данных позволяет считать, что наблюдаемый электрохимический процесс на электроде с иммобилизованной лакказой определяется реакцией четырехэлектронного восстановления кислорода до воды:
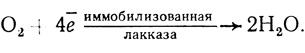 (4.32)
(4.32)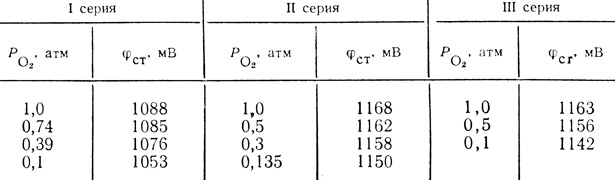
Таблица 36. Зависимость стационарного потенциала от парциального давления кислорода
Величина тока, снимаемого с электрода, при заданном потенциале зависит от количества иммобилизованной лакказы и в принципе выходит на пределы, предсказанные кинетической моделью биоэлектрокатализа.
Кислородные электроды на основе иммобилизованной на саже лакказы достаточно стабильны. Из рис. 81 видно, что эксплуатация электрода в течение 50 ч не приводит к заметному падению потенциала.
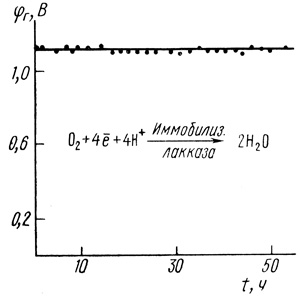
Рис. 81. Стабильность электрода из сажи с иммобилизованной лакказой при токе поляризации 87,5 мкА
Таким образом, полученные результаты показывают возможность электрокатализа ферментом реакции восстановления кислорода по механизму прямого безмедиаторного переноса электронов по цепи электрод-активный центр - молекула кислорода. Возможность прямого переноса электронов с электрода на активный центр фермента связана, по-видимому, со специфической ориентацией фермента на поверхности электрода. Как известно, лакказа активно окисляет гидрофобные ароматические соединения. Можно думать, что сорбция лакказы на поверхности электрода идет с участием гидрофобной области активного центра фермента.
Полученные результаты создают возможность разработки эффективных электродов биоэлектрокаталитического восстановления кислорода.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'