
Глава 3. Комплексные соединения
В каком же виде находится тот или иной металл в клетках организма? Бесспорно, в виде положительно заряженного иона. Как хорошо известно, соли металлов под действием воды (а в клетках организмов содержится около 70-75% воды) диссоциируют - распадаются на положительные ионы металлов (катионы) и отрицательно заряженные ионы (анионы) кислотных остатков, например:
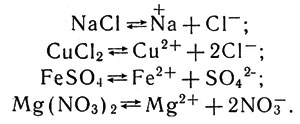
Cоли металлов под действием воды
Следовательно, в водных растворах солей находятся катионы металлов, им-то и надо приписать все те свойства, с которыми встречается ученый, исследующий роль металлов в организмах.
Так ли это? Не совсем так!
Ион металла, находящийся в водном растворе того или иного вещества, вовсе не безразличен к своему окружению. Он вступает во взаимодействие с молекулами воды и образует соединения, в которых на один ион приходится от 4 до 8 (а в отдельных случаях и более) молекул воды. Казалось бы, нет прямой связи между валентностью металла и числом присоединяемых молекул, да и вообще непонятно, как нейтральная (т. е. не имеющая свободных валентностей) молекула воды может присоединяться к иону.
Теория валентности приписывала каждому атому определенное число единиц валентности (обозначаемых черточками), причем предполагалось, что атом водорода одновалентен. Если какие-либо другие атомы присоединяли к себе, например, два, три или четыре атома водорода, то это означало, что данные атомы двух-, трех- и четырехвалентны: двухвалентна сера в сероводороде H2S, трехвалентен азот в аммиаке NH3, четырехвалентен углерод в метане СН4 и т. д. Величина валентности изменяется от 1 до 8, и если в молекуле соединения все валентности насыщены (нет свободных единиц-черточек), то такая молекула уже не может соединяться с другой частицей. Поэтому молекула воды, структурная формула которой 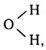 , не должна, казалось бы, присоединяться к иону металла.
, не должна, казалось бы, присоединяться к иону металла.
Фактически дело обстоит не так, и молекулы воды образуют с ионами металлов разнообразные соединения. Они отличаются рядом характерных свойств, в частности окраской.
Хлорид меди CuCl2 высушенный, т. е. безводный, окрашен в светло-коричневый цвет. Бросим щепотку этой соли в воду, получится раствор голубой окраски. Ионы хлора бесцветны, голубую окраску надо приписать соединению иона меди и молекул воды. Проверим это. Попробуем заменить воду иным растворителем, например ацетоном; если голубая окраска свойственна водному соединению, то в ацетоне должна наблюдаться другая окраска, независимо от того, реагирует ли ион меди с ацетоном или нет. Хлорид меди растворяется в ацетоне, образуя раствор зелено-коричневого цвета. При добавлении в него избытка воды раствор делается голубым. Все это убеждает нас в том, что ионы металла с водой (и, вероятно, с ацетоном) образуют какие-то соединения. Еще Д. И. Менделеев - творец сольватной теории растворов - указывал на бесспорные признаки химической реакции в процессе растворения многих веществ. Измерения обнаруживают и выделение теплоты при растворении безводных солей: безводные хлорид и сульфат меди сильно разогреваются при добавлении к ним воды. С другой стороны, если попробовать удалить воду из раствора сульфата меди, то можно получить красивые синие кристаллы, имеющие состав CuSO4*5H2O. Для того чтобы удалить и эти оставшиеся молекулы воды (четыре из них, как доказано, окружают ион меди и одна соединена с сульфат-ионом), придется сильно нагреть кристаллы; тогда они, теряя воду, становятся почти белыми.
Все это позволяет сделать уверенный вывод, что молекулы способны прочно присоединяться к ионам меди, заметно изменяя их свойства, в частности окраску. Молекулы воды присоединяются и к ионам других металлов - кальция, железа, магния, натрия и др. При медленном испарении воды из растворов солей удается получить кристаллы, содержащие соль и определенное количество молекул воды на каждую молекулу соли. Выделенные в чистом виде, такие соединения носят название кристаллогидратов. К кристаллогидратам относят соединения: CuCl2*2H2O, CuSO4*5H2O, а также СаСl2*6Н2O, CaSO4*2H2O, Na2SO4*10H2O и др.
Но не только вода, а и другие соединения могут взаимодействовать с ионами металлов в растворах. Добавим, например, к водному раствору какой-либо соли меди (можно взять раствор хлорида СuСl2) избыток водного аммиака. Сначала появится зеленовато-голубой осадок, затем он быстро исчезнет, а жидкость приобретет красивый темно-синий цвет. Что произошло? Первые порции водного аммиака вступили в реакцию с хлоридом меди, и получился осадок гидроксида меди (II):
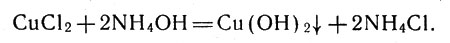
Реакция водного аммиака с хлоридом меди
Растворение осадка и появление синей окраски указывают на развитие другой реакции. В результате взаимодействия гидроксида с молекулами аммиака, которые всегда имеются в водном растворе аммиака, получилось соединение - аммиакат меди:
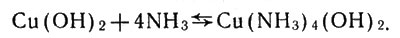
Взаимодействие гидроксида меди с молекулами аммиака
Это соединение способно диссоциировать, отщепляя ионы ОН-:
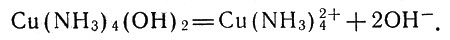
Диссоциация аммиаката меди
Молекулы аммиака прочно связаны с ионами меди, и синяя окраска - это свойство именно комплексного иона Cu(NH3)24+. Следовательно, к ионам металлов могут присоединяться не только молекулы воды, но и молекулы других соединений, в частности аммиака.
Обширные исследования таких комплексных молекул и ионов привели ученых к выводу, что комплексообразование представляет собой одно из самых распространенных явлений в химии металлов. Было установлено, что практически ионы всех металлов способны образовывать комплексные соединения с различными молекулами органических и неорганических соединений. Известны, например, следующие соединения: Со(NН3)6Сl2, Pt (NH3)Cl2, Сr(NН3)6Сl3, [NiEn3]Cl2 и др. (Символ Еn обозначает молекулу этилендиамина H2N - CH2 - СН2 - NH2.) Прочно связанные молекулы аммиака или этилендиамина в этих соединениях размещены в непосредственной близости от центрального иона металла - их называют лигандами (что значит "связанные").
Лиганды могут нести электрический заряд, т. е. быть ионами. В таких случаях заряд всего комплексного иона получается алгебраическим суммированием заряда всех лигандов и заряда центрального иона. Примером может служить комплексное соединение иона железа (II) с цианид-ионами CN-. Комплекс [Fe(CN)6]4- имеет отрицательный заряд, так как центральный ион заряжен двумя положительными, а шесть ионов-лигандов несут шесть отрицательных зарядов. Комплексный ион может удерживать четыре однозарядных катиона, например четыре иона калия. Выделенная из раствора комплексная соль имеет состав K4[Fe(CN)6].
Число лигандов, располагающихся в непосредственной близости от центрального иона, называют координационным числом иона (сокращенно его обозначают КЧ). Часто встречаются координационные числа 2, 4, 6; числа 3, 5, 7 встречаются крайне редко. Известны и очень большие координационные числа - 8, 12, 18. В таблице 3 приведены некоторые примеры типичных координационных соединений* с различными КЧ.
* (В современной научной литературе комплексные соединения часто называют координационными; оба термина равнозначны.)
Величина координационного числа определяется относительными размерами иона и лигандов и величиной электрического заряда центрального иона. Большой заряд и малые размеры иона благоприятствуют высоким координационным числам.
| Формула иона | КЧ | Геометрическая форма иона |
|---|---|---|
| [Ag(NH3)2]+ | 2 | Линейная |
| [HgI3]- | 3 | Треугольник |
| [Cu(NH3)4]2+, [PtCl4]2- | 4 | Квадрат |
| [MnCl5]3- | 5 | Пирамида |
| [PtCl6]2-, [Ca(H2O)6]2+ [Fe(CN)6]4- |
6 | Октаэдр |
| [Zr(C2O4)4]4- | 8 | Куб |
Иногда в молекуле органического соединения находятся две или более групп, способных присоединяться к иону металла. В таких случаях одна молекула-лиганд занимает вблизи от иона (в так называемой координационной сфере иона) не одно, а два или более мест.
Примером может служить уже упоминавшееся соединение иона меди с молекулами этилендиамина. Этилендиамин H2N-СН2-СН2-NH2 имеет в составе две группы - NH2, активно присоединяющиеся к иону меди, и каждая молекула занимает два места в координационной сфере:
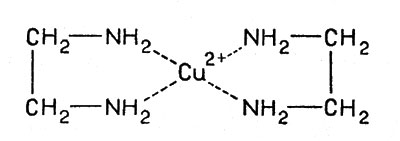
Cоединение иона меди с молекулами этилендиамина
Как видно из формулы, комплексообразование в этом случае приводит к возникновению циклов: ион меди, соединяясь с атомами азота, замыкает два цикла (пунктир обозначает связи между ионом и атомами азота лиганда). Такие комплексы называют хелатными ("клешнеобразными").
В таблице 3 указано соединение иона циркония с анионами щавелевой кислоты. Здесь лигандом является отрицательно заряженный ион С2O4-. Формула щавелевой кислоты:
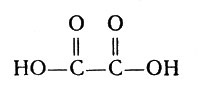
Формула щавелевой кислоты
Формула аниона:
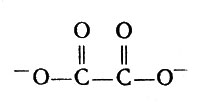
Формула аниона щавелевой кислоты
Каждый анион занимает два координационных места; всего четыре таких частицы-лиганда занимают восемь мест, поэтому координационное число циркония равно 8.
По мере расширения круга исследований неорганических и органических веществ число комплексных соединений металлов с различными лигандами все увеличивалось. Постепенно выяснилось, что перед химиками открывается совершенно новая область науки, имеющая первостепенное значение для решения целого ряда теоретических и практических вопросов. Ученым пришлось заново пересмотреть теорию химической связи и понятие валентности. Большой вклад в учение о комплексных соединениях внесли русский ученый Л. А. Чугаев и его ученики, синтезировавшие множество новых веществ и изучившие их свойства. Позже успешная работа над координационными соединениями была продолжена в исследованиях школы акад. И. И. Черняева, А. А. Гринберга, физико-химиков Л. Полинга, Р. Пирсона, К. Бальхаузена и др.
Достижения химии комплексных соединений оказали сильное влияние на развитие биохимии. Если ранее можно было только констатировать, что металлы - железо, медь, кобальт, цинк и др. - необходимы для жизни организмов, то теперь удалось раскрыть механизм их работы и понять, что ион металла всегда действует в форме комплекса.
Для биохимии особенно важны комплексные соединения железа и магния, в которых четыре координационных места занимает одна частица, называемая порфином:
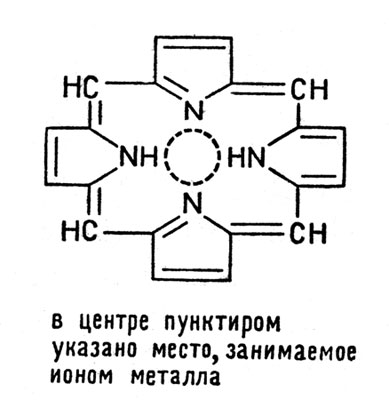
Комплексные соединения железа и магния
Практически в организмах встречаются комплексы, в которых некоторые атомы водорода в порфине замещены на различные органические группы -СН3, -СН2-СН2-СООН и др., но основной каркас этой сложной молекулы сохраняется в целом ряде важнейших веществ: в гемоглобине, хлорофилле и в различных ферментах, ускоряющих процессы обмена веществ.
Молекулы комплексных (координационных) соединении отличаются вполне определенной геометрической структурой. Так, два одинаковых лиганда часто располагаются около иона металла таким образом, что центры иона и частиц-лигандов оказываются на одной прямой. Три лиганда размещаются по углам треугольника, четыре - по углам квадрата или четырехгранника (тетраэдра) шесть - по углам восьмигранника (октаэдра) (рис. 1), восемь - по углам куба. Если лиганды неодинаковы, то геометрические формы могут быть и не совсем правильными (искаженными), но тем не менее лиганды остаются фиксированными в определенных точках пространства вокруг центрального иона. В последнем столбце таблицы 3 указаны характерные геометрические формы некоторых координационных соединений, образующих в растворах ионы с различными КЧ.
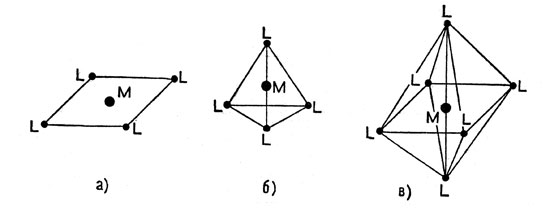
Рис. 1. Расположение лигандов (L) вокруг центрального иона в комплексных соединениях: а - квадрат; б - тетраэдр; в - октаэдр. Центральный ион отмечен буквой М
Геометрическая форма того или иного комплексного иона сохраняется и в том случае, когда вещество выделяют из раствора в виде кристаллов. Следовательно если, например из раствора соли K2PtCl6, содержащего ноны К+ и [PtCl6]2-, выделить кристаллы этой соли то и в кристаллах сохранятся октаэдры (восьмигранники) PtCl62-, т. е. анионы наряду с катионами - ионами калия К+.
Устойчивость геометрической формы комплексного нона ведет к двум важным следствиям.
Во-первых, оказывается, что одно и то же координационное соединение, содержащее лиганды нескольких видов, может существовать в нескольких формах, различающихся способом размещения лигандов и соответственно физическими и химическими свойствами. Так, соединение Pt(NH3)2(NO2)2Cl2, имеющее лиганды трех сортов, может существовать в пяти различных формах (положение иона платины указано точкой в центре квадрата):
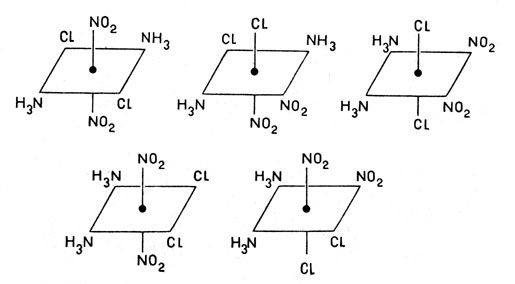
Соединение Pt(NH3)2(NO2)2Cl2, имеющее лиганды трех сортов, может существовать в пяти различных формах (положение иона платины указано точкой в центре квадрата):
Все пять форм были получены советскими учеными И. И. Черняевым и Г. С. Муравейской. Это явление аналогично явлению изомерии, характерному для органических соединений. Очевидно, все вышенаписанные формулы представляют строение изомеров одного и того же координационного соединения Pt(NH3)2(NO2)2Cl2.
Во-вторых, геометрическая форма комплекса влияет на способность центрального иона металла вступать в те или иные взаимодействия с дгими молекулами. Если ион металла имеет координационное число 6 и находится в центре октаэдра, то он, конечно, довольно хорошо изолирован от внешней среды, и молекулам, с которыми о бы вступить в соединение, трудно до него добраться. Но если тот же ион располагается в центре плоского квадрата и имеет КЧ, равное 4, то он открыт с двух сторон. Даже в том случае, когда с одной стороны ион уже присоединил какую-либо частицу (например, частицу белка), все равно с другой стороны к нему открыт доступ.
Именно так обстоит дело с гемоглобином. Комплекс железа с протопорфирином (замещенным порфином) имеет плоское строение, КЧ равно 4. Кроме того, с одной стороны к иону железа присоединена молекула белка (глобин), но шестое место в координационной сфере свободно. Это место и занимает молекула кислорода, переносимого гемоглобином в процессе дыхания. Если бы комплекс железа имел КЧ, равное 6, и ион железа был бы изолирован от среды, гемоглобин не мог бы переносить кислород, необходимый для дыхания клеток.
Как видно, даже геометрические особенности координационных соединений имеют жизненно важное значение. Одной из самых характерных особенностей химии координационных соединений является глубокое различие между свойствами простого иона и иона, окруженного лигандами. Иначе говоря, свойства комплексного иона существенно зависят от химической природы как центрального иона, так и лигандов (табл. 4).
| Ион металла | Лиганд | Свойство комплексов с данным лигандом | Свойства гидротированного иона |
|---|---|---|---|
| Медь | Аммиак, амины | Реагируют с целлюлозой, темно-синяя окраска; бурно разлагают пероксид водорода | Не реагируют с целлюлозой, слабоголубая окраска; медленно разлагают пероксид водорода |
| Железо | Порфин (его производные) | Переносят кислород. Энергично разлагают пероксид водорода, ускоряют окисление различных веществ | Не способен переносить кислород. Окислительные свойства выражены относительно слабо |
| Цинк | Белки То же |
Ускоряют разложение гидрокарбонатов. Способствуют усвоению белков | Не влияет на разложение гидрокарбонатов и усвоение белков |
| Молибден | Белки | Способствуют усвоению бактериями атмосферного азота | Не влияет на усвоение атмосферного азота |
| Магний | Производное порфина | Хлорофилл обусловливает превращение диоксида углерода и воды в углеводы (фотосинтез) | Не ускоряет фотосинтез |
Ионы металлов, не связанные с лигандами, встречаются редко. В сущности, химик может наблюдать свойства такого "простого" иона металла разве что при очень высоких температурах в газообразной среде, нагревая ту или иную соль до температур порядка тысяч градусов. В растворах солей ионы металлов связаны с молекулами воды (гидратированы) и, следовательно, находятся там в виде комплексов. Но заменим молекулы воды на молекулы аммиака, например в растворе соли меди CuCl2. Как мы уже знаем, при этом получится темно-синий комплекс, имеющий свойства, которых нет у гидратированного иона.
Гидратированные ионы слабо окрашены, они легко взаимодействуют с ионами карбоната, образуя осадок карбоната меди, практически не реагируют с целлюлозой. А вот комплексные ионы Cu(NH3)42+ с ионами карбонатов СО32- осадка не образуют, а целлюлозу (например, вату) в щелочной среде растворяют (на этом основан один из способов получения искусственного шелка). Ионы цинка в виде гидратного комплекса не влияют на разложение кислых солей угольной кислоты, а комплексное соединение цинка, содержащееся в крови, ускоряет распад гидрокарбонатов и выделение из крови в легкие диоксида углерода. Не будь этого комплекса в организме, мы не могли бы дышать, так как освобождение крови от углекислоты происходило бы слишком медленно. Наконец, если бы исчезло комплексное соединение магния - хлорофилл, то растения не могли бы развиваться и жизнь на Земле, лишившись притока поддерживающей ее солнечной энергии, прекратилась бы! Отсюда следует, что, изменяя состав комплексов, природа может в очень широких пределах варьировать свойства соединений данного металла и для решения множества биохимических задач обходиться относительно небольшим числом металлов.
Суммируем вкратце, что мы узнали о том, каким образом действуют ионы металлов в клетках организма.
Металлы находятся в клетках в виде комплексных соединений с различными органическими, веществами: белками, различными производными порфина и др. Комплексные ионы присоединяют к себе частицы-лиганды так, что получается правильная геометрическая форма: треугольник, тетраэдр, октаэдр и т. п. Одно или два места около иона могут остаться свободными, и туда попадают другие молекулы, например молекула кислорода в частицу гемоглобина. Все лиганды занимают определенные положения и относительно иона, и относительно друг друга; они, как говорят, правильно ориентированы в пространстве.
Ион металла имеет положительный заряд и притягивает к себе отрицательные заряды - электроны, находящиеся в молекулах (или ионах) лигандов. Таким образом, молекулы лигандов поляризуются. Но свойства комплексного иона так своеобразны и так сильно зависят от природы лигандов, что приходится предположить, что между лигандами и центральным ионом металла образуются химические связи. Это значит, что ион и лиганды имеют общие электроны.
Вопрос об электронном строении координационных соединений вызывал споры среди ученых на протяжении не одного десятка лет. Казалось очень странным, что к соединению, в котором явно насыщены все валентности, можно присоединить нейтральные молекулы. Придумывали очень сложные структурные формулы, приписывали атомам несвойственные им валентности, но все это не привело к успеху. Только развитие теории строения атома и химической связи, а также достижения квантовой химии помогли понять, почему образуются координационные соединения и какова их роль в процессах обмена веществ в организмах.
Почему вообще возникает химическая связь? Рассмотрим простой пример: соединяются атомы лития и фтора. В атоме лития, как известно, содержится три электрона. Два из них связаны очень прочно, а третий находится во втором слое и связан слабее. В атоме фтора во втором слое уже семь электронов (а всего их в атоме фтора девять). При взаимодействии атома лития с атомом фтора слабо связанный электрон лития переходит к атому фтора и занимает место во втором слое. Этот процесс сопровождается уменьшением запаса потенциальной энергии атомов и происходит легко. Избыток энергии выделяется в виде теплоты и частично в виде света. После перехода электрона атом фтора приобретает отрицательный заряд, так как у него теперь один "лишний" электрон, а атом лития заряжается положительно (у него не хватает одного электрона). Оба заряженных атома (их надо называть уже не атомами, а ионами) притягиваются друг к другу и образуют молекулу фторида лития:
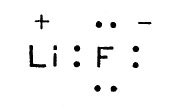
Молекула фторида лития
(При понижении температуры получится кристалл фторида лития, в котором находятся ионы лития и фтора.) В этом простом примере валентность атома лития и атома фтора равна единице. Восемь электронов, окружающих ядро иона фтора, и пара электронов около ядра иона лития, как доказано, образуют очень простое сочетание. Соответственно и хлорид лития - прочное соединение. Опыт и теория показали, что так просто нельзя себе представлять картину образования химических связей во всех случаях. Во-первых, отданный атомом лития электрон не полностью переходит "во владение" атома фтора. Фактически получается пара электронов, область движения которых охватывает оба атома. Во-вторых, химическая связь может образоваться и тогда, когда оба связывающих электрона принадлежат одному атому. Рассмотрим в качестве примера атом азота, вступающий в соединение с тремя атомами водорода. В результате получается молекула NН3 - молекула аммиака; атом азота в ней, очевидно, трехвалентен. Схематически это и отражено в формуле:
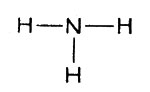
Атом азота, вступающий в соединение с тремя атомами водорода
В атоме азота пять внешних электронов. Три из них использованы для соединения с атомами водорода. Каждый атом водорода отдает по одному электрону для образования пар, связывающих оба атома. Схема электронного строения аммиака выглядит так:
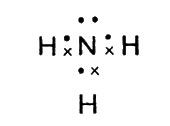
Схема электронного строения аммиака
Здесь электроны, принадлежавшие атомам водорода, условно обозначены крестиками, электроны азота - точками. Легко заметить, что атом азота имеет пару электронов, которая не принимает участия в связывании.
Допустим, что молекулы аммиака попадают в среду, в которой находятся ионы водорода Н+ (в раствор какой-либо кислоты). Ионы водорода немедленно присоединяются к свободной паре электронов азота, и получится химическая связь - точно такая же, как и три другие. Однако на этот раз в образовании связи принимали участие электроны не двух атомов, как в предыдущем примере, а только одного! Связи, возникшие таким путем, называются координационными.
А не могут ли сами молекулы аммиака за счет своих свободных электронных пар присоединяться к ионам металлов? Весь вопрос в том, будет ли происходить при этом снижение запаса потенциальной энергии всех частиц, - это ведь обязательное условие образования прочных химических связей.
Развитие идей квантовой механики привело к выводу, что электроны в атомах размещены на определенных энергетических уровнях и переход электрона с одного уровня на другой соответствует скачкообразному изменению запаса энергии атома. Чем больше номер периода, в котором находится элемент, тем больше число уровней в его атоме. На каждом уровне может находиться лишь строго определенное число электронов (на первом уровне два электрона, на втором - восемь, на третьем - восемнадцать и т. д.).
Если число электронов на данном уровне мало (или если на уровне вообще нет электронов, хотя они могли бы там находиться), то другая частица, имеющая свободную (неподеленную) пару электронов, вполне может передать эту пару на свободный (вакантный) уровень.
Ион меди располагает такими свободными уровнями, поэтому четыре молекулы аммиака легко передают ему четыре пары своих электронов, в результате чего и возникают четыре химические связи, соединяющие ион меди с молекулами аммиака, - получается тот самый темно-синий комплексный ион Cu(NH3)42+, о котором шла речь выше.
В примере с фторидом лития было указано, что электроны, связывающие ионы лития и фтора, образуют общую систему и движутся так, что в своем движении они охватывают оба атома. Квантовая механика ничего не говорит о движении электрона, ее методы позволяют вычислить только вероятность того, что электрон находится в данной части пространства. Поэтому вместо того чтобы рисовать пути движения электрона в атоме или молекуле (траектории или орбиты), ограничиваются геометрическим описанием той области пространства около ядра атома, где вероятность найти электрон достаточно велика. Эта область пространства может иметь форму сферы (s-электроны), или гантели (р-электроны), или розеткообразной фигуры (d-электроны). Часто поэтому говорят об электронных "облаках", когда хотят приближенно представить себе распределение электронных зарядов в атоме или молекуле.
В координационных соединениях, имеющих электроны электронных пар различных лигандов и электроны иона металла, существуют электронные облака, охватывающие сразу несколько частиц (ион и отдельные группы атомов в лигандах). Точные расчеты распределения вероятностей найти электрон в этом облаке очень сложны и требуют знания волновых функций электронов во всех частицах. Волновой функцией называют математическую зависимость между координатами электрона в атоме (именно к волновой функции относится термин "орбиталь", который не надо путать с "орбитой" прежних теорий строения атома).
Мы не будем углубляться в квантовую механику - для нас достаточно знать, что электроны иона металла и электроны соединенных с ним атомов лигандов образуют общие электронные облака. Так обстоит дело в соединениях иона меди с аммиаком, железа с порфином и т. д. В дальнейшем мы несколько подробнее разберем этот вопрос на примере соединений железа, входящих в состав ферментов, а теперь перейдем к общему описанию ферментов - удивительных веществ, ускоряющих химические реакции в клетках и действующих более точно и согласованно, чем химические цехи на самых лучших современных заводах.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'