
Глава 4. Ферменты и металлы
Ферментами называют природные белковые катализаторы. Некоторые ферменты имеют чисто белковый состав и не нуждаются для проявления своей активности в каких-либо иных веществах. Однако существует обширная группе ферментов, активность которых проявляется только в присутствии определенных соединений небелковой природы. Эти соединения называются кофакторами. Кофакторами могут быть, например, ионы металлов или органические соединения сложного строения - их обычно называют коферментами. В большинстве случаев связь между коферментом и белком слабая и кофермент можно отделить от белка. Субстратом называется вещество, которое изменяется под действием фермента.
Известны сочетания кофермента с белком, в которых связи между ними прочны и разделить кофермент и белок можно только с большим трудом. Тогда вместо "кофермент" применяют термин "простетическая группа". Такие прочные связи обнаружены в ферментах, содержащих гем - комплексное соединение железа с производным порфина, упоминавшееся в предыдущей главе. В качестве активаторов-кофакторов в ферментах встречаются ионы железа, меди, цинка, магния, марганца, калия, натрия, молибдена. Роль коферментов в важнейших процессах, катализируемых ферментами, играют сложные вещества, молекулы которых иногда представляют сочетание нескольких звеньев, состоящих из органических оснований, углеводных остатков, остатков аминокислот и т. п.
Многие коферменты являются витаминами и жизненно необходимы для организма. Установлено, что для нормальной работы фермента иногда требуется и кофермент, и ион металла, образующие вместе с молекулой субстрата тройной комплекс. Так металлы входят в состав биологических машин как незаменимая часть. Ионы магния нужны для работы по переносу остатков фосфорной кислоты, для этих же целей нужны и ионы калия; гидролиз белков требует ионов цинка и т. д. Ниже мы разберем эти вопросы детально.
Ферменты, как правило, ускоряют однотипные реакции, и лишь немногие из них действуют только на одну определенную и единственную реакцию. К таким ферментам, обладающим абсолютной специфичностью, относится, в частности, уреаза, разлагающая мочевину. Большинство ферментов не столь строги в выборе субстрата. Одна и та же гидролаза, например, способна катализировать гидролитическое разложение нескольких различных сложных эфиров.
По мере того как в биологических исследованиях их химическая сторона углублялась и химики все чаще становились помощниками и сотрудниками биологов, число вновь открываемых ферментов неуклонно возрастало; вскоре их пришлось считать уже не десятками, а сотнями. Такое расширение круга биологических катализаторов вызвало некоторые трудности в классификации и номенклатуре ферментов.
Раньше ферменты называли по тому субстрату, на который они действовали, с прибавлением окончания "аза". Так, если фермент действует на сахар мальтозу, то его называли "мальтаза", если на лактозу - "лактаза" и т. д. В настоящее время принята номенклатура, в которой название отражает также и химическую функцию фермента. Частица "аза" сохранена для простых ферментов. Если же в реакции участвует комплекс ферментов, применяют термин "система".
Ферменты делят на шесть классов:
- Оксидоредуктазы. Это ферменты, катализирующие окислительно-восстановительные реакции. Примером оксидоредуктаз могут служить пируватдегидрогеназа, отнимающая водород от пировиноградной кислоты, каталаза, разлагающая пероксид водорода, и др.
- Трансферазы. Трансферазы осуществляют перенос с одной молекулы на другую целых атомных групп. Они могут переносить группы СН3, СООН, Н2РО3 и др.
- Гидролазы. Эти ферменты вызывают разрыв связей типа
и подобные им с последующим присоединением воды:
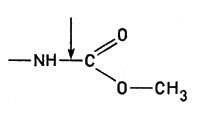
Гидролазы вызывают разрыв связейК гидролазам относятся пищеварительные ферменты пепсин, химотрипсин и др., а также липазы, расщепляющие жиры.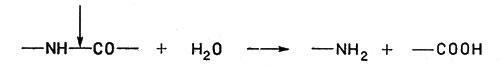
Гидролазы вызывают разрыв связей с последующим присоединением воды - Лиазы. Лиазы тоже расщепляют связи С-С, С-N, С=O и др., но без участия воды, т. е. негидролитическим путем.
- Изомеразы. Эти ферменты способствуют частичной перестройке молекул субстрата.
- Лигазы. Лигазы обеспечивают соединение молекул субстрата, причем энергия, необходимая для этого, доставляется аденозинтрифосфатом (АТФ).
Уже простое перечисление этих функций наводит на мысль, что ферменты действуют в клетках не в одиночку, а совместно, последовательно перекраивая молекулы пищевых веществ: разрывая одни связи, создавая другие, изменяя общий каркас молекулы, перенося на нее или отнимая от нее целые группы атомов и т. д. Ферменты, в отличие от большинства технических катализаторов, функционируют в составе сложных систем; работа их согласована так, что продукт деятельности одного фермента обязательно попадает в сферу влияния вполне определенного другого, и скорости превращений на всех стадиях химического конвейера клетки также строго согласованы и регулируются автоматически.
Клетка и организм располагают и средствами управления своими "химическими заводами", так как клетка не только пользуется ферментами, но и сама создает их. Если при данных условиях работу какой-либо цепочки ферментов необходимо прекратить, так как вырабатываемый ею продукт имеется в избытке, выключается синтез соответствующих ферментов или подавляется деятельность одного из них, и таким образом весь конвейер временно останавливается. Это значит, что ферментная система пространственно организована. Она организована также во времени, потому что ферменты активируются и даже появляются в большей концентрации в те моменты, когда клетка нуждается в их деятельности.
Молекулярная масса ферментов велика и измеряется десятками, сотнями тысяч и даже миллионами. Ниже (табл. 5) приведены молекулярные массы некоторых ферментов.
Изучение химического состава ферментов показало, что все они без исключений содержат белок. Белковая природа ферментов объяснила многие детали их синтеза в клетках, причины, по которым они легко фиксируются на мембранах. И вместе с тем появилась важная проблема в теории катализа - вопрос о механизме действия биологических катализаторов, которые, обладая очень сложной геометрической структурой, не являются вполне "жесткими", подобно кристаллическим оксидам или металлам, а могут изменяться уже в процессе каталитической реакции.
| Фермент | Относительная молекулярная масса | Функция фермента |
|---|---|---|
| Рибонуклеаза | 1,4*104 | Гидролиз рибонуклеиновой кислоты |
| Химотрипсин | 2,16*104 | Гидролиз белков |
| Пепсин | 3,9*104 | Гидролиз белков |
| Уреаза | 48*104 | Разложение мочевины |
| Амилаза | 15*104 | Гидролиз крахмала |
| Карбонангидраза | 3*104 | Разложение гидрокарбонатов |
На белковых молекулах ферментов имеются зоны или области, в которых и развивается каталитическая реакция. Можно, по аналогии с обычными катализаторами, называть эти зоны активными центрами. Активный центр ферментов, катализирующих некоторые окислительно-восстановительные реакции, в частности каталазы (разлагающей пероксид водорода), состоит из комплексного соединения железа с порфирином (замещенным порфином). Направленность действия фермента в значительной мере зависит от природы того белка, который входит в его состав.
В состав различных ферментов входят разные металлы. Так, марганец входит в состав аргиназы, разлагающей некоторые составные части белков, цинк - в карбон-ангидразу. Медь содержится в аскорбиноксидазе - ферменте, окисляющем витамин С. Во многих растениях содержится фермент пероксидаза. Он усиливает окисление органических веществ пероксидом водорода. Активная группа этого фермента состоит из комплексного иона железа такого же типа, что и в каталазе. Если добавить к ферменту раствор сероводорода, то железо прочно соединится с серой и фермент потеряет активность.
В других ферментах, например в тех, которые катализируют гидролитическое разложение белков (пепсин в желудочном соке), активный центр не содержит инородных соединений, а представляет собой просто совокупность отдельных частей длинной цепеобразной молекулы белка, сближенных друг с другом в результате изгиба сложной цепи. Следовательно, активный центр фермента может возникнуть как результат определенной деформации белковой частицы; другими словами, геометрические особенности полипептидной цепочки, из которой белки и состоят, имеют большое значение для проявления каталитических свойств.
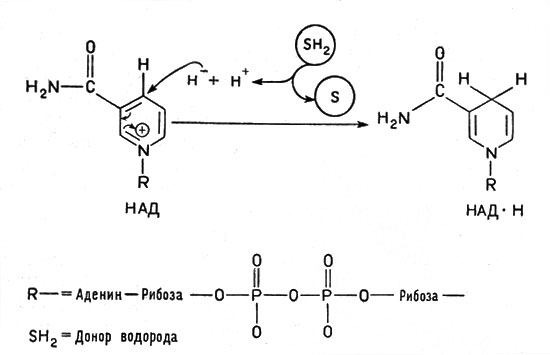
Рис. 2. Превращение окисленной формы кофермента НАД в восстановленную. Водород от окисляемого вещества (субстрата, обозначенного SH2) переходит к НАД+ (на кольцо пиридина в никототинамиде) в виде гидридного иона Н-. Другой ион водорода Н+ переходит в окружающую среду
Очень большую роль в обмене веществ играют ферменты, облегчающие перенос водорода, - дегидрогеназы. Они содержат белковую часть и кофакторы. Важнейшим кофактором (коферментом) является так называемый НАД, или никотинамидадениндинуклеотид, молекула которого состоит из сочетания аденина (органическое основание), рибозы (углевод, содержащий пять атомов углерода) и двух остатков фосфорной кислоты, связывающих "мостиком" другой остаток рибозы, соединенный в свою очередь с никотинамидом:
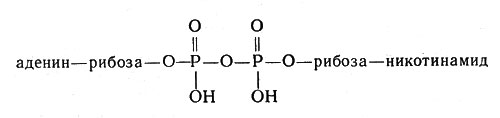
Молекула НАД или никотинамидадениндинуклеотид
Это сложное соединение, связанное с белком, обладает способностью, отнимая от другого вещества водород, присоединять его и передавать дальше следующему переносчику. При этом водородный атом присоединяется к никотинамидному кольцу в виде отрицательного иона Н-, образуя восстановленный НАД - НАД*Н, а второй ион Н+ субстрата поступает в окружающую среду. В целом от молекулы субстрата отнимается два атома водорода (рис. 2). Аналогичные функции выполняет и другой кофермент - ФАД, или флавинадениндинуклеотид, построенный так же, но содержащий вместо никотинамида флавиновую группу более сложного строения. Благодаря флавиновой группе ФАД способен восстанавливаться, присоединяя два атома водорода и образуя ФАД*Н2 (рис. 3).
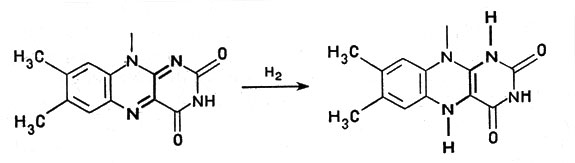
Рис. 3. Восстановление флавинадениндинуклеотида (показана флавиновая часть молекулы ФАД)
Рассмотрим некоторые важные ферменты, в состав которых входит железо.
Каталазы. Ферменты, относящиеся к этой группе, разлагают пероксид водорода на воду и кислород. Широкая распространенность и большая активность, о которой мы упоминали, позволяют обнаружить фермент в различных животных и растительных тканях простейшими средствами.
Достаточно бросить в аптечный раствор пероксида водорода кусочек моркови, картофеля, мяса, как сейчас же будет заметно энергичное выделение пузырьков газа (кислорода) на их поверхности: это действует каталаза. Под влиянием пероксида водорода фермент и сам медленно разлагается, но в слабых растворах (а в клетках концентрация пероксида невелика) каталаза работает долго и энергично, устраняя опасности, связанные для организма с действием такого сильного оксислителя, каким является пероксид*.
* (Снижение содержания каталазы в эритроцитах ведет к тяжелым болезненным явлениям, например, у человека - к гангрене полости рта (Б. К. Саундерс).)
Хотя наблюдения подобного рода делались давно, чистую кристаллическую каталазу удалось получить лишь в 1937 г. Молекулярные массы каталаз различного происхождения лежат в пределах 225000-250000; на одну белковую молекулу приходится четыре иона железа.
В процессе взаимодействия каталазы с пероксидом образуется неустойчивое промежуточное соединение зеленого цвета. Именно оно и служит тем важным звеном, которое определяет весь ход каталитического разложения пероксида.
При больших концентрациях пероксида (по Чансу) каталаза образует с пероксидом еще два соединения - одно из них, красного цвета, слабоактивно, а другое вовсе не обладает каталитической активностью.
Промежуточное зеленое соединение реагирует со второй молекулой пероксида по схеме:
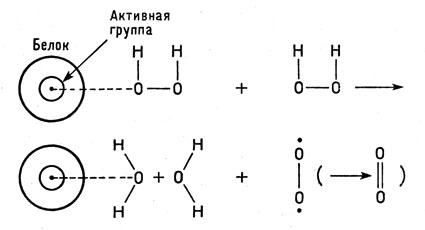
Каталитическое разложение пероксида
Ион железа в каталазе находится в степени окисления +2 (см. гл. 7).
В последнее время получены данные, указывающие, что каталаза способна ускорять не только разложение пероксидов, но и другие реакции, например окисление спиртов.
Пероксидаза. Функция фермента пероксидазы заключается в том, что она ускоряет окисление различных веществ (доноров водорода) пероксидом водорода. Первые наблюдения над действием пероксидазы относятся еще к 1855 г. (Шенбейн), но тщательное изучение ее природы и свойств началось только в 30-х гг. нашего века.
Пероксидаза - это белковый комплекс, причем ион железа в нем находится в степени окисления +3. Так же как и в других порфириновых белковых комплексах, пятое место в координационной сфере железа занято белком, а шестое свободно и является реакционным пространством комплекса - к нему присоединяются те группы, которые участвуют в катализе.
Молекулярная масса пероксидазы относительно невелика и составляет 40000. Пероксидаза окрашена в коричневый цвет, в ее белковой части содержится также и углевод (уроновая кислота).
Чанс, исследовавший механизм действия пероксидазы, выделенный из корня хрена (в этом растении содержание пероксидазы особенно велико), пришел к выводу, что фермент образует с пероксидом водорода три соединения, проявляя в этом отношении некоторое сходство с каталазой. Одно из этих соединений зеленое и два - красных. Зеленое очень непрочно и легко переходит в одно из красных (другое получается при большом избытке пероксида). Реакция окисления соединения (например, аскорбиновой кислоты), которое мы условно обозначим АН2, заключается в отнятии от АН2 водорода, соединяющегося с кислородом пероксида. Схема реакции с участием пероксидазы, которую мы обозначим Пер -ОН, такова:
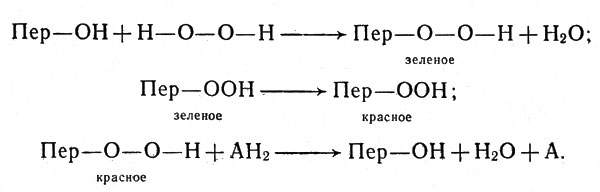
Схема реакции с участием пероксидазы
Некоторые исследователи считают, что в пероксидазе во время этой реакции железо переходит в высшие степени окисления (+4), но окончательно этот вопрос еще нельзя признать решенным.
Модели ферментов. Большой интерес вызывает вопрос о возможности создания катализаторов, менее сложных по составу, чем ферменты, но вместе с тем столь же активных и избирательно действующих. Речь, следовательно, идет о получении моделей ферментов на основе сравнительно простых систем. Еще в начале XX в. Г. Бредиг обнаружил, что мелкораздробленные металлы (например, платина) проявляют способность сильно ускорять некоторые реакции, в частности разложение пероксида водорода. Такие "металлические модели", конечно, мало походили на белковые катализаторы, но все же стало ясно, что высокая каталитическая активность не является свойством, присущим только ферментам.
В 50-х г. Л. А. Николаев исследовал "медные модели" фермента каталазы, состоящие из комплексных соединений меди, и доказал, что ион меди, окруженный молекулами аммиака или аминогруппами, например в комплексах:
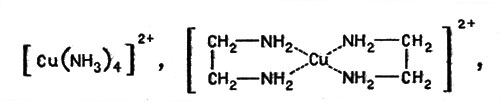
Ион меди, окруженный молекулами аммиака или аминогруппами
проявляет очень большую каталитическую активность в реакции разложения пероксида водорода. Позже были изучены реакции гидролиза (Р. Густавсон и С. Чибрик), ряд окислительных реакций (А. П. Пурмаль и др.), исследован механизм процессов катализа (А. П. Пурмаль, А. Я. Сычев и др.) и установлено, что многие комплексные соединения металлов вполне могут рассматриваться как модели активных групп металлосодержащих ферментов.
В настоящее время ведутся работы по изучению сочетаний комплекс металла - высокомолекулярный носитель; такая система уже совсем близка к природным ферментам. С другой стороны, фиксируя природный фермент на носителе, например на силикагеле, в приборе, называемом хроматографической колонкой, можно повысить его устойчивость и сделать более удобным использование фермента в производственных условиях. Такие "иммобилизованные" ферменты (т. е. зафиксированные на носителе) находят все большее применение в технологии производства пищевых продуктов.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'