
Золотой ключик
Как вы, вероятно, уже догадались, этим золотым ключиком и являются водородные связи.
Известно, что между двумя любыми достаточно близко расположенными молекулами возникают силы взаимного притяжения: электронная оболочка одной молекулы притягивается положительным зарядом (системой ядер) другой молекулы. Эти силы получили название Ван-дер-Ваальсовых.
Если бы между молекулами воды действовали только Ван-дер-Ваальсовы силы взаимного притяжения, вода замерзала бы при -90°С (183 К), а закипала бы при +80°С (353 К). В действительности вода замерзает при 0°С и закипает при +100°С - обстоятельства, долгое время смущавшие физиков и химиков. Недоумения были рассеяны после открытия водородных связей, более мощных, чем Ван-дер-Ваальсовы.
Водородные связи проявляются не только в воде. Они играют решающую роль в процессе биологического синтеза, т. е. в образовании молекул растительного и живого вещества. Все растущее и живущее на Земле обязано своим существованием специфичности самого распространенного во вселенной элемента - водорода. Однако ни в каком другом веществе водородные связи не проявляются в такой полной мере, как в воде.
Огромный дипольный момент молекул воды и водородные связи объясняют прежде всего аномально высокую диэлектрическую постоянную воды. Если принять диэлектрическую постоянную вакуума за единицу, то диэлектрическая постоянная воды будет равна 80. Это значит, что в воде два электрических заряда будут взаимно притягиваться или отталкиваться с силой, в 80 раз меньше той, с которой они взаимодействовали бы в вакууме.
Высокая диэлектрическая постоянная, в свою очередь, объясняет феноменальную способность воды растворять в себе буквально все вещества, существующие в природе. На Земле не найти абсолютно чистой Н2О. Все воды, включая и дождевую, и родниковую, и многократно дистиллированную, - растворы. Конечно, концентрация растворенных веществ может колебаться в очень широких пределах. Самый распространенный "раствор" на поверхности Земли - морская вода. В каждой ее капле по крайней мере 70 химических элементов таблицы Менделеева, в том числе и самых редких.
Особенно легко растворяются в воде вещества, атомы которых соединены ионной связью. Это сравнительно слабые химические связи. Растворенная в воде, например, поваренная соль легко диссоциирует на ионы натрия (Na+) и хлора (Сl-). Соединиться вновь в воде этим ионам не суждено. Разделенные молекулами воды, они теперь притягиваются друг к другу в 80 раз слабее! К тому же вставшие на их пути молекулы Н2О обладают мощным дипольным моментом и без труда присоединяют к своим отрицательным концам положительные ионы натрия, а отрицательные ионы хлора соответственно исчезают в цепких "лапах" водородных протонов.
Пример растворения солей с ионной связью мы выделили потому, что такие связи составляют основу образования кристаллических структур, а из кристаллических структур в основном и сложена кора Земли, ее материки, горные хребты, дно океанов. Как уж тут не проявиться всеразрушающему свойству воды?
Не следует думать, будто водородные связи намертво удерживают одну молекулу воды относительно, другой. Если бы это случилось, вода при всех условиях оставалась бы сверхпрочным твердым телом. В интервале между 0 и +100 °С водородные связи ослабляют и рвутся под воздействием теплового движения самих молекул воды. Чем больше мы подводим тепла к воде, тем интенсивнее тепловое движение молекул и тем труднее водородным связям удерживать их на близком расстоянии друг подле друга. Наконец, тепловое движение окончательно берет верх над силами водородных связей, молекулы рассыпаются, разлетаются, вода перестает быть жидкостью, она обращается в пар.
Но чтобы полностью разрушить водородные связи, к воде нужно подвести значительное количество тепла - 2260 кДж/кг. Вот то обстоятельство, которое объясняет феноменальную теплоемкость воды, ее способность выполнять роль аккумулятора тепла в глобальных масштабах.
На поверхности воды "оголенные" протоны остаются "не у дела". Здесь им не на чем испытать силу своего воздействия: выше нет атомов кислорода. И тогда водородные протоны уподобляются притаившимся в ожидании жертвы осьминогам. Стоит только поднести к свободной поверхности воды предмет, в котором есть атомы кислорода, как протоны вцепятся в них "щупальцами" своих водородных связей. Этим и обуславливается способность воды смачивать те или другие вещества.
Прочность воды! Напомним, что согласно теоретическим расчетам, изготовленный из идеально чистой воды стержень диаметром 1 см должен был бы выдержать растягивающую силу в 37,49*104Н. Теперь уточним - подобные расчеты основываются на прочности водородных связей. Как перейти от теории к практике? Для этого нужно найти способ зафиксировать водородные связи. Вообще-то он известен - это охлаждение воды, превращение ее в лед (мы вернемся к этому позднее). Нам же хотелось бы придать воде не просто кристаллическую структуру, свойственную льду, а идеальную, упорядоченную структуру, которая и даст нам желанную сверхпрочность. Как сделать это, увы не придумали еще даже фантасты.
Что же, собственно, происходит при охлаждении воды? Прежде всего, здесь особенно наглядно проявляются ее аномальные свойства. Мы уже знаем, что вода, охлаждаясь от +100°С до + 4°С, как и все вещества в природе, сжимается, уменьшается в объеме. А затем от +4°С и до самого замерзания она увеличивается в объеме.
В чем тут дело? Конечно же, в специфичности водородных связей. Пока энергия теплового движения достаточно велика, "голому" водородному протону не удается зацепиться за атом кислорода "проплывающей" поодаль молекулы Н2О. "Багор с крючком", которым протон пытается пленить атом кислорода, либо, не выдержав, лопается, либо (и это чаще всего) оказывается слишком длинным. "Крючок багра" повисает над "головой" плывущего поблизости к протону кислородного атома.
Вот примерно какая ситуация должна иметь место, пока температура воды выше +4 °С. Молекулы воды имеют возможность скользить бок о бок, почти вплотную друг к другу. В это время в воде существует так называемый ближний порядок. Однако по мере охлаждения скорость движения молекул воды начинает падать. Теперь у протона есть время, чтобы вначале отодвинуть "багром" атом кислорода на длину "багра", а затем надежно зацепить его "крючком". Поскольку скорость движения мала, прочности "багра" будет вполне достаточно, чтобы остановить плененную молекулу Н2О и присоединить ее к собственной молекуле Н2О. Обратите внимание: молекула будет остановлена на строго определенном расстоянии, равном длине "багра".
У каждой молекулы Н2О два "голых" водородных протона, поэтому она захватывает сразу двух оказавшихся поблизости "соседок". Но одновременно на ее собственный атом кислорода будут переброшены два "багра" с других не менее расторопных протонов.
Так, быть может несколько упрощенно, мы с возможной наглядностью нарисовали картину возникновения кристаллической структуры льда - возникновение тетраэдров, которые начнут выстраиваться один за другим, как солдаты на плацу.
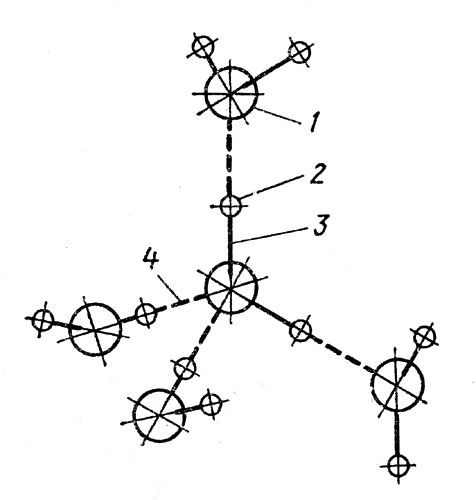
Рис. 11. Образование водородных связей между молекулами воды. 1 - кислород; 2 - водород; 3 - ковалентные связи; 4 - водородные связи. Каждая молекула перекидывает два мостика и одновременно на нее перекидываются два мостика. В результате возникает геометрическая фигура - тетраэдр
Так как для построения тетраэдра молекулы должны вначале отодвинуться одна от другой на определенные расстояния, объем, занимаемый замерзающей водой, естественно, увеличивается. И он будет расти до тех пор, пока вся вода не обратится в лед (рис. 11).
- Но, позвольте! - вправе удивится читатель. - Раз уж в кристаллах льда водородные связи проявили себя в полную силу, где же предсказанная вами "сверхпрочность"? Почему лед не стал прочнее стального сплава?
А потому, дорогой читатель, что в лед перешли все "пороки" воды: растворенные в ней газы и механические примеси. Кристаллическая структура льда полна всевозможных дефектов: трещин, уродливых нагромождений, втиснувшихся в парадный строй кристаллов атомов примесей. И от возможной сверхпрочности не осталось и следа.
Нет, обычным превращением воды в лед сверхпрочности не достичь. Кстати, аналогичную картину мы наблюдаем и в металлургии. Твердеющий расплав - тот же лед. Теория показала, что сталь и даже чистое железо могли бы стать по крайней мере в 1000 раз прочнее, если бы удалось получить идеальную кристаллическую структуру без искажения геометрии кристаллической решетки. Но, увы, здесь, как и в воде, делают свое "грязное" дело газовые включения и посторонние механические примеси.
Раз уж речь зашла о льдах... Чтобы превратить лед в воду, его нужно нагреть. При этом каждый килограмм льда потребует довольно приличного количества тепла - 340 кДж. Однако с оговоркой: 340 кДж, если лед взят при 0°С и при нормальном атмосферном давлении. Для расплавления 1 кг льда, взятого при минус 7°С, достаточно уже 323,24 кДж, а при минус 13°С понадобится еще меньше - 310,7 кДж. Получается, что с каждым градусом вниз по шкале термометра теплота плавления льда убывает на 2,1 кДж.
Не удивительно ли? Чем холоднее лед, тем легче его превратить в воду! Вот вам и еще одно "чудачество" воды, которое может быть объяснено только специфичностью водородных связей.
Как странно иногда совершаются научные открытия! Сколько мудрецов до Архимеда пользовались ванной, но ни одному из них в голову не приходило усмотреть в льющейся через края воде явление необычайной важности.
А вот пример сегодняшнего дня. Уже не одно столетие клянет человечество воду за ее коварное свойство: замерзая в трубах, рвать их стенки. А сколько нерадивых шоферов и по сей день "размораживает" автомобильные двигатели, оставляя в них зимой воду?
Но почему-то никто, в том числе и мы с вами, не задумывались над тем, какая огромная, не используемая человеком, сила действует на наших глазах.
27 февраля 1974 г. газета "Советская индустрия" сообщила о замечательном изобретении московского инженера П. А. Радченко. Суть изобретения сводится к сварке, с помощью льда! Точнее, с помощью того давления, которое возникает в момент превращения воды в лед. Количество потребляемой воды - объем куриного яйца. Источник холода - в зимнее время воздух с улицы: ведь очень-то низких температур и не требуется - нуля вполне достаточно.
Не даром говорят: "Все великое - просто!"
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'