
3.7. Волны в форме лепестков

Четыре волны-лепестка атома углерода. Справа - деталь (один лепесток) такой волны
Итак, удобные волны, занятые электронной парой, обеспечивают устойчивость связей между атомами. Эти волны тем удобнее, чем точнее направлены друг к другу гребни обоих атомов и чем больше они перекрываются. Для того чтобы облегчить перекрывание, атом может смешать все свои волны и из этой смеси приготовить новые волны, которые будут специально направлены к соседним атомам. Волны такого типа открыты американским ученым Лайнусом Полингом.
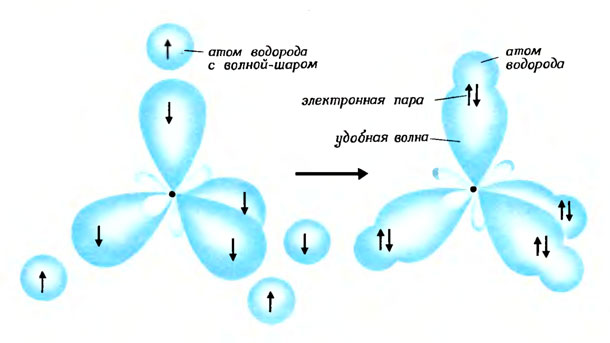
Образование молекулы метана: каждый из четырех атомов водорода отдает свой электрон на образование пар с четырьмя электронами углерода, находящимися в волнах-лепестках
Так, смешав три волны - восьмерки с волной-шаром, атом углерода создает из них четыре гибридные волны-лепестка, направленные в четыре разные стороны. Против каждого гребня-лепестка имеется маленькая впадинка. Если рядом находятся четыре атома водорода со своими волнами-шарами, могут образоваться четыре удобные связывающие волны. Связь атома углерода с каждым из атомов водорода обеспечивается электронными парами, которые образуются из четырех электронов атома углерода и четырех электронов, внесенных атомами водорода. Получающаяся при этом молекула метана, как мы уже знаем, имеет форму тетраэдра. Эта способность атома углерода к образованию четырех связей, расположенных в пространстве в виде тетраэдра, была открыта сто лет назад голландским ученым Вант-Гоффом и французским химиком Ле Белем. Именно этой способностью объясняется существование левых и правых молекул; эта способность лежит в основе одного из разделов химии, называемого стереохимией.
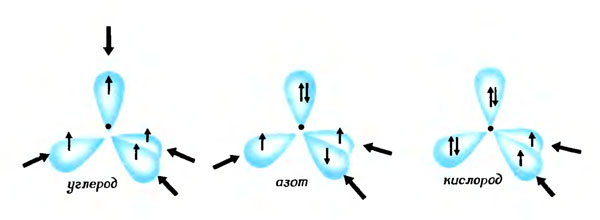
Число неспаренных одиноких электронов, которые могут войти в волны-лепестки (в углероде - четыре, в азоте - три и в кислороде - два), определяет 'связывающую способность' атомов (для углерода - 4, для кислорода - 2 и для азота - 3). Большие стрелки показывают направления, в которых могут образовываться связи
У некоторых атомов, например атомов азота и кислорода, в одной или нескольких волнах-лепестках уже имеется готовая электронная пара; такую пару называют "изолированной", или "свободной". Поэтому способность таких атомов образовывать связи с другими атомами (знаменитое химическое понятие валентности) меньше, чем у атома углерода: кислород может образовывать лишь две связи, а азот - три.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'