
3.8. Двойная связь
Иногда атом углерода отдает две или три свои связи какому-нибудь одному атому. В этом случае говорят о двойных или тройных связях, которые изображают на рисунке соответственно двумя или тремя черточками.
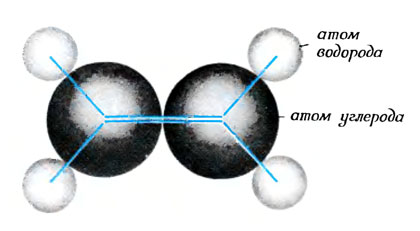
Молекула этилена (вид сверху на плоскость, в которой расположены атомы)
В молекуле этилена два атома углерода связаны между собой двумя связями. Поэтому у каждого из них три соседа: два атома водорода и другой атом углерода. Чтобы образовать эти три связи атом углерода использует две (из трех) волны-восьмерки и волну-шар и создает три волны-лепестка в плоскости молекулы. И еще у каждого атома углерода остается по одной нетронутой волне-восьмерке, направленной перпендикулярно плоскости молекулы. Оба атома углерода делят между собой первую удобную волну (внутреннюю), внося в нее по одному лепестку. Эту удобную волну занимает первая пара электронов. Вторая удобная волна (внешняя) образуется при взаимодействии волн-восьмерок, оставшихся нетронутыми. При этом наверху сливаются два гребня, а внизу - две впадины*. Новая молекулярная волна простирается, как мантия, сверху и снизу плоскости, в которой расположены атомы. Эту волну занимает вторая пара электронов. На рисунке эта пара помещена в гребень волны, но точно так же она может находиться и во впадине. Возможен и такой вариант, когда один из партнеров занимает гребень, а другой - впадину. Атомы углерода прочно связываются такой связью; расстояние между ними короче, чем между атомами, связанными простой (одинарной) связью.
* (Значит, эта волна имеет зону покоя в плоскости молекулы. Но в отличие от неудобной волны, эта зона покоя не разделяет ядра, а потому и не мешает электронам.)
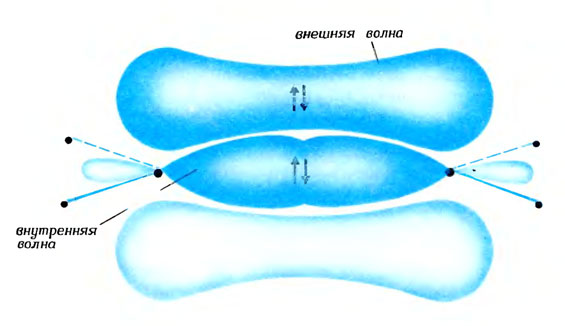
Две удобные волны двойной связи (вид сбоку)
Двойная связь благодаря своей силе придает молекуле определенную прочность. Но в то же время - вот вам многоликость природы - она делает молекулу более реакционноспособной: оба атома углерода могут пожертвовать одну из своих двух связей, все еще сохраняя близость между собой.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'