
4.4. Расставания и встречи
А теперь попробуем разбить электронную пару. Одна из таких пар, которую не так трудно разбить, расположена во внешней удобной волне связи между атомами углерода в молекуле этилена. О ней мы уже говорили выше. Не стоит делить пару, удаляя друг от друга атомы углерода, ведь тогда придется бороться сразу с двумя парами - внешней и внутренней! Лучше всего повернуть плоскость, в которой расположены три правых атома, относительно плоскости, в которой находятся три левых атома. Скрутив таким образом молекулу, мы разделяем волны-восьмерки обоих атомов углерода. Образованная из них удобная волна в результате этого разрушается, так как ни гребни, ни впадины уже не могут объединиться, а внутренняя волна при этом не страдает.
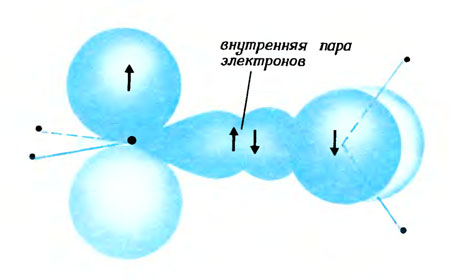
Разрыв внешней электронной пары при скручивании молекулы этилена
Когда угол поворота достигнет 90 градусов, происходит полный разрыв пары: обе половинки молекулы удерживаются только одной электронной парой. Поэтому такая скрученная молекула очень неустойчива, и вращение будет продолжаться до тех пор, пока два правых атома водорода не изменят свое положение на противоположное. Тогда оба разделенных электрона снова встретятся и снова образуют единую пару. И молекула этилена восстановится заново.
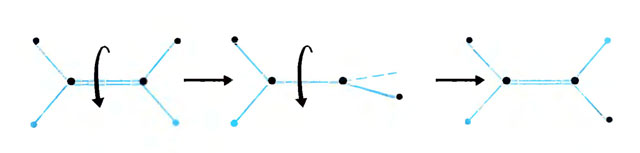
'Изотопные' атомы дейтерия, изображенные голубыми точками, помогают распознать реакцию скручивания молекулы
Даже для разделения одной внешней электронной пары нужно придать молекуле солидное количество энергии путем нагревания по крайней мере до 500°С. Чтобы удостовериться, что реакция действительно происходит, химик заранее метит молекулу двумя атомами дейтерия, которые во всем похожи на атомы водорода: и своими волнами, и единственным электроном, - но у которых ядра тяжелее. Благодаря этим "изотопным" атомам дейтерия, можно отличить получившуюся после вращения молекулу от исходной.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'