
4.5. Союз двух... и вечный треугольник
Вообще говоря, разделение электронной пары, будь то временное или окончательное, дело еще более трудное, чем разрыв внешней электронной пары молекулы этилена. Разводы "по-молекулярному" редки. Можно сказать, что молекулярными реакциями управляет заповедь: "Не разбивай электронных пар". В мире молекул она соблюдается строже десяти библейских заповедей.
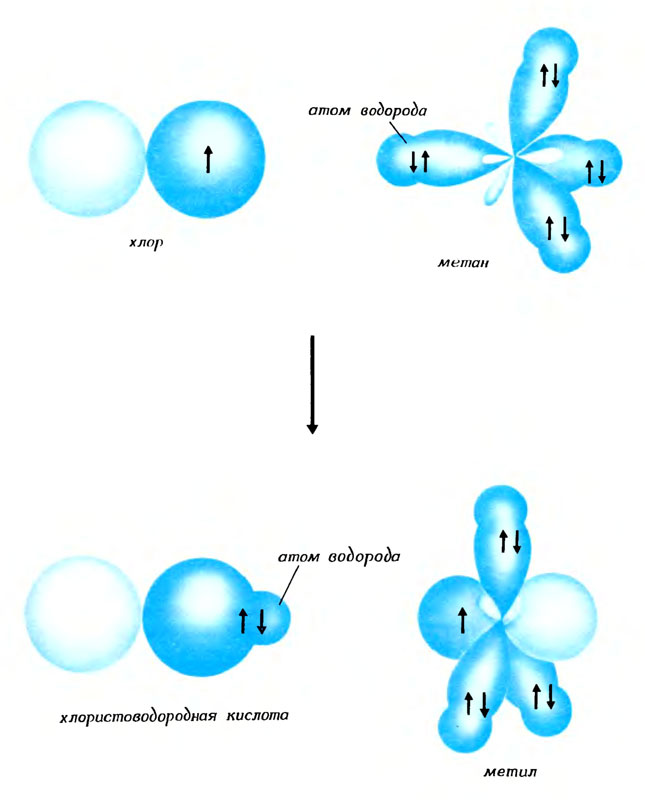
Одиночный электрон атома хлора отрывает электрон от пары, осуществляющей связь углерода с водородом. Так, атом хлора отрывает атом водорода
Самыми прочными, противящимися разрыву являются пары, скрепляющие простой связью атомы углерода и водорода или два атома углерода. Как раз такие связи между атомами углерода и водорода существуют в молекуле метана. В самом деле, электронная пара, обеспечивающая каждую связь, прочно закреплена в очень удобной волне, и потому пребывает в состоянии полного счастья. Путем сильного нагревания мы добьемся своего, но, вероятнее всего, при этом будет разорвана вся молекула. А для того чтобы достичь цели мягким обращением, нужно использовать весьма изощренные внешние средства.
Разрыв электронной пары чаще всего происходит, как и у людей, когда ее покой нарушает третий, одинокий электрон. Если такой электрон, принадлежащий другой молекуле, оказывается поблизости от нашей пары, события развиваются стремительно. Одиночка-гурман стремится занять в паре место электрона с таким же сокровенным свойством, как и у него. Если одиночке удается вытеснить законный электрон (а так часто случается), то в атакованной молекуле связь рвется, а в напавшей молекуле образуется новая связь. Например, атом хлора может отнять у молекулы метана атом водорода и образовать молекулу хлористого водорода.
Однако следует заметить, что вместо первой пары электронов появляется другая пара - на второй молекуле, - и поэтому можно считать, что просто первая электронная пара поменялась местами с электроном-одиночкой (ведь у электронов нет собственного лица, и отличить их один от другого невозможно). А значит, заповедь не нарушена.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'