
4.6. Электрохимия
Электрохимия - это раздел химии, разработанный английским ученым Фарадеем. Метод электрохимии дает возможность обеднять или обогащать молекулу электронами. Подведем молекулу к электроду - электрически заряженной металлической пластинке. Если электрод страдает электронным голоданием (положительно заряжен), он захочет отнять электрон у молекулы, а если он переполнен электронами (заряжен отрицательно), то захочет отдать их избыток молекуле.
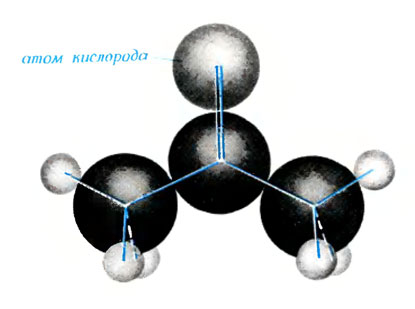
Молекула ацетона
В молекуле ацетона, как и в молекуле метана, имеются связи, где электронные пары устроились основательно. Это особенно относится к связям между атомами углерода.
Подведем молекулу ацетона к электроду с недостатком электронов: один электрон покинет молекулу. Если при этом затрачено достаточно большое количество энергии, этим электроном может оказаться один из партнеров пары, обеспечивающей углерод - углеродную связь. Так как в удобной волне остался только один электрон, связь может довольно легко разорваться, и тогда образуются ацильная частица с электроном-одиночкой и обедненная электронами метильная частица*.
* (Описанная реакция всего лишь модель, реально она происходит с молекулами, подобными молекуле ацетона.)
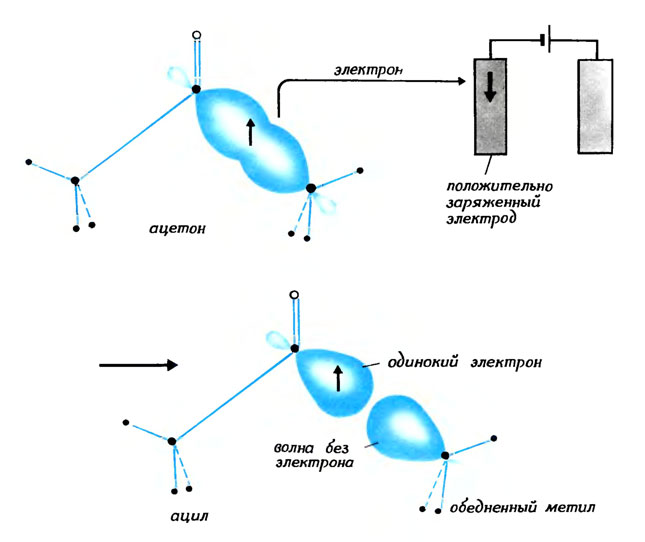
Потеряв под действием электрода один из своих электронов, углерод - углеродная связь разрывается, и образуются две частицы: ацильная и обедненная метальная
В других молекулах удается добиться разрыва пары, добавляя третий электрон с электрода с избытком электронов. Этот электрон проникает в неудобную волну, принадлежащую связи, о которой идет речь. Так же как в описанном ранее случае с двумя атомами гелия, присутствие электрона-одиночки в неудобной волне разрушит прочность связи: благополучная пара распадется и связь разорвется.
Поэтому электрохимия представляет собой мощный промышленный метод создания новых молекул: их получают, разделяя некоторые молекулы на части, из которых потом составляют подходящие композиции. В частности, электрохимический синтез служит для получения уже известных нам молекул найлона.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'