
5.2. Волны в виде лент
В молекуле бензола каждый атом углерода окружен только тремя соседними атомами. Поскольку атомы водорода могут образовывать только одну простую связь, каждый атом углерода в кольце должен быть соединен с одним из соседних атомов углерода двойной связью. Тогда для молекулы в целом имеются два возможных варианта, которые представлены на рисунке и которые были открыты немецким химиком Кекуле в 1867 г. Но молекула бензола не решается принять одну из этих возможных форм. Такое колебание между двумя химическими структурами, которое американский химик Полинг назвал резонансом, служит фактором стабильности. В действительности молекула выбирает промежуточную структуру: все углерод-углеродные связи бензола имеют одинаковую длину. Они длиннее двойной, но короче простой связи.
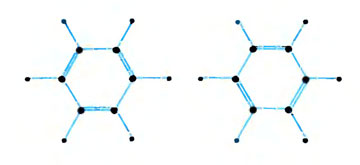
Молекула бензола колеблется в выборе между этими двумя структурами
Особенности геометрии молекулы бензола находят свое глубокое объяснение в природе удобных волн этой молекулы, которые устроены так же, как и волны в молекуле этилена. Прежде всего с помощью волн-лепестков образуются в молекуле шесть периферических углерод-углеродных связей. Затем остающиеся волны-восьмерки по одной на каждом атоме углерода, соприкасаясь друг с другом, создают еще шесть волн, которые охватывают всю молекулу. Так же как и при встрече двух атомных волн, образуется одинаковое число удобных (три) и неудобных (три) волн. Проследите за гребнями или впадинами таких удобных волн: они лентой вьются вокруг нескольких атомов. В одной из волн гребень образует полный круг. В двух других гребень имеет меньший размер и разделен на два участка зоной покоя.
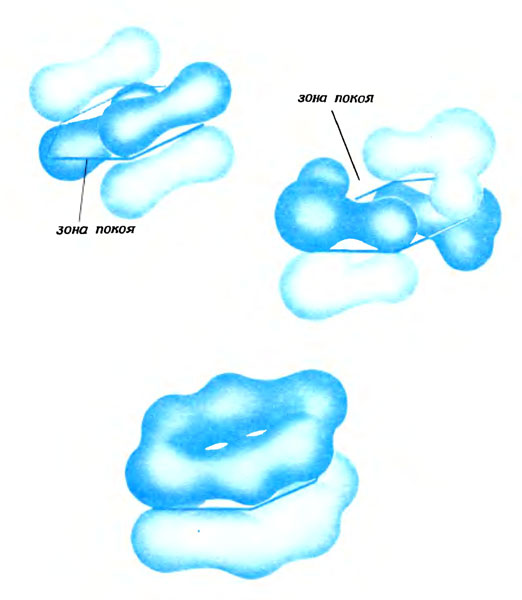
Три удобные волны-ленты в молекуле бензола. В каждой содержится по электронной паре
Первая из трех волн самая удобная. Действительно, чем большую протяженность имеет гребень волны, тем она удобнее, так как у длинных волн уменьшается число резких переходов от гребня к впадине, сопровождающихся появлением зон покоя между атомами углерода. В отличие от первой удобной волны молекулы бензола в двух других волнах такой резкий переход существует. В каждой из трех удобных волн находится электронная пара. В принципе эти три пары могут сформировать три двойные связи в молекуле. Но так же как молекула колеблется в распределении своих трех связей, три удобные пары служат в равной степени укреплению шести углерод-углеродных связей.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'