
5.3. Правило 2, 6, 10
Если молекула бензола так устойчива, то чем же объяснить неустойчивость молекулы циклобутадиена, представляющей собой правильный квадрат? Почти сто лет химики искали это вещество, и им удалось его выделить на очень короткое время лишь при очень низких температурах. Однако его можно стабилизировать атомами металла в виде супермолекулы циклобутадиентрикарбонила железа, похожей на молекулы-сэндвичи, о которых мы рассказывали выше.
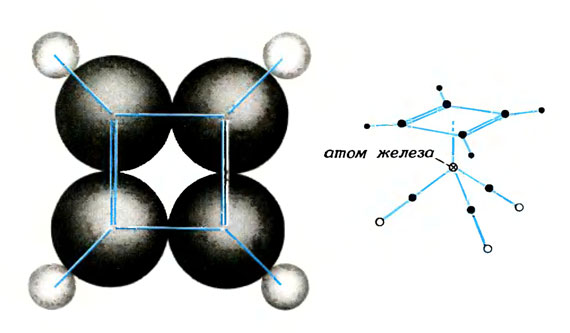
Молекула циклобутадиена очень неустойчива, устойчивой она может стать только в супермолекулах, например в циклобутадиентрикарбониле железа
Все это говорит о том, что жизнь молекул управляется очень тонкими законами. Исполнителями этих законов служат электроны и их волны. Один из основных законов касается стабильности молекул, он позволяет или не позволяет ансамблю атомов построить устойчивое здание. Закон требует, чтобы электронные пары занимали только удобные волны. Так это было в молекуле бензола, а раньше мы это видели на примере молекул водорода, метана и этилена. И напротив, в молекуле циклобутадиена с двумя электронными парами в волне-ленте только одна из них находит подходящую удобную волну. Вторая же должна довольствоваться волной, у которой характер серединка наполовинку - ни совсем удобный, ни совсем неудобный. Заселение этой "безликой" волны и приводит к малой стабильности молекулы.
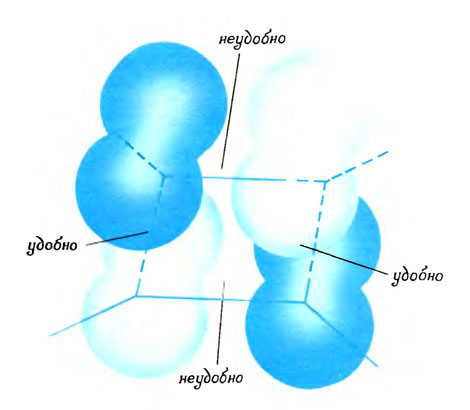
Неустойчивость молекулы циклобутадиена вызвана присутствием электронной пары в 'безликой' волне-ленте, где удобные и неудобные свойства уравновешены
Различие между бензолом и циклобутадиеном иллюстрирует химическое правило 2, 6, 10, которое гласит, что среди молекул, атомные волны которых соприкасаются гребнями, образуя волну-ленту, устойчивы лишь те, которые имеют 2, 6, 10... электронов, или 1, 3, 5... электронных пар!
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'