
Глава 8. Как происходит горение?
Со времен Лавуазье прошло два века. За это время был более детально изучен процесс горения, получил новое объяснение и его механизм.
Под горением понимают сложный физико-химический процесс, основой которого является быстро протекающая реакция окисления, сопровождающаяся выделением большого количества тепла и ярким свечением. Горение начинается с воспламенения. Оно возникает при определенных условиях (температуре, давлении и т.д.), когда происходит самоускорение химических превращений, результатом которых и является воспламенение (самовоспламенение).
Различают два механизма воспламенения - тепловой и цепной. Первый механизм связан с существованием энергии активации соответствующих реакций. Вообще говоря, способные к химическому взаимодействию составные части газовой смеси (топлива с воздухом) реагируют друг с другом и при более низких температурах, чем то отвечает появлению пламени, т.е. быстро протекающей реакции, сопровождающейся выделением тепла и света. Однако при этом взаимодействуют только отдельные молекулы, поэтому выделяющееся сравнительно небольшое количество тепла быстро рассеивается вследствие теплопроводности, лучеиспускания и т.д.
По мере повышения температуры в месте нагрева число активных молекул около него растет, и выделение тепла в результате их взаимодействия соответственно увеличивается. При определенных температурных условиях (соответствующих температуре воспламенения) вблизи места нагрева создается такое положение, когда за единицу времени тепла выделяется больше, чем рассеивается. Это приводит к нагреву до температуры воспламенения соседних участков системы, от которых подобным же образом массовая активация молекул распространяется на другие участки и т.д. Результатом является резкое увеличение скорости процесса во всем реакционном пространстве, проявляющееся в возникновении пламени.
В случае цепного механизма воспламенение объясняется тем, что выделяющаяся химическая энергия идет на образование реакционноспособных частиц (атомов и радикалов), а увеличение их числа вызывает самоускорение (автоускорение) реакции. При этом практически измерить скорость реакции нельзя, так как она изменяется (возрастает) очень быстро. При тепловом же воспламенении скорость реакции измерить можно. Кроме того, цепное воспламенение идет в основном при низких температурах, и даже минусовых, тогда как тепловое-обычно при высоких температурах.
Воспламенение переходит в горение. Последнее характеризуется тем, что поддерживается само собой, - новые порции топлива загораются без подачи дополнительного тепла. Горение в большинстве случаев объясняется цепными реакциями. Как они возникают?
В 1913 г. немецкий химик Макс Боденштейн изучал реакцию хлора с водородом на свету. Активные молекулы в этом случае образуются за счет поглощения квантов света (фотонов). Согласно фотохимическому закону, установленному в 1908-1912 гг. знаменитыми физиками Альбертом Эйнштейном и Иоганнесом Штарком, при поглощении одного кванта света во время фотохимической реакции образуется одна молекула продукта, в данном случае НС1. Количество же поглощенных квантов легко определить, зная время освещения и его интенсивность. Боденштейн именно так и поступил, но подсчеты показали, что иногда один поглощенный квант света вызывал сотни тысяч реакций, дающих хлороводород. Как это объяснить?
Боденштейн предложил механизм неразветвленного цепного процесса, в котором активными частицами, ведущими цепь, были электрон и активные молекулы хлора, образующиеся при взаимодействии нейтральных молекул с электроном. Последний образуется при ионизации молекул хлора квантом света по реакции:
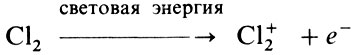
Однако от ионизационного механизма вскоре пришлось отказаться, поскольку эксперименты не обнаружили в реакционной смеси электронов.
Через три года Боденштейн предложил впервые в истории химии механизм энергетических цепей для объяснения фотохимического хлорирования водорода. Активными частицами при этом были богатые энергией молекулы хлора, возникающие при поглощении квантов света.
Существовали и принципиально иные объяснения механизма цепных реакций. Так, в 1918 г. знаменитый немецкий физикохимик Вальтер Нернст высказал предположение, что цепные реакции происходят с участием свободных атомов (имеющих неспаренный электрон). Вот как выглядит реакция в современной записи.
Первая стадия - зарождение цепи:
hv
Сl2 → 2Сl
вторая - продолжение, или рост цепи:
Н2 + Сl → НСl + Н; Сl2 + Н → НСl + Сl;
Н2 + Cl -" HCl + Н и т.д.
последняя стадия-обрыв цепи:
Н + Н → Н2; Н + Cl → HCl и т.д.
Так возникла теория цепных реакций, объясняющая многие химические процессы.
В 1925-1926 гг. в лаборатории Николая Николаевича Семенова (будущего академика, лауреата Государственных, Ленинской и Нобелевской премий) в Ленинградском государственном физико-техническом институте изучалось свечение фосфора в присутствии кислорода. В процессе этой реакции выделяется много энергии, что ведет к возникновению активных частиц, которые при столкновении отдают часть своей энергии другим частицам. Остальная часть энергии выделяется в виде света. Но вот что оказалось неожиданным и интересным. При понижении давления реакция, казалось бы, должна постепенно замедляться. Действительно, когда давление в сосуде становилось ниже некоторой определенной величины, свечения не наблюдалось, но стоило только чуть повысить давление, как сразу происходила вспышка. Этими опытами было окончательно доказано существование критического давления кислорода в реакции его с фосфором, т.е. существование резкого перехода от практически полной инертности фосфора и кислорода к бурной реакции. Одним из самых удивительных явлений природы назвал Семенов столь необычное поведение газовых смесей.
Кроме того, оказалось, что если в сосуд, где проводилась реакция, добавить немного инертного газа (аргона, неона), то воспламенение фосфора наступит при его меньшей концентрации, хотя эти газы не являются участниками основной исследуемой реакции.
Опубликование столь необычных результатов, естественно, породило недоверие многих химиков. Даже Боденштейн считал, что при проведении опытов в лаборатории Семенова были допущены принципиальные ошибки. Ленинградские ученые вновь повторили исследования. Результаты подтвердились.

Николай Николаевич Семенов (1896-1986*)
* (Годы жизни добавлены Злыгостевым А.С. 2011 г. Информация взята из wikipedia.org)
Семенов считал, что начальными активными частицами являются атомы кислорода. Реагируя с фосфором, они образуют активную молекулу Р4O, которая, взаимодействуя с молекулой кислорода, восстанавливает первоначальную активную частицу-атом О
Р4О + О2 = Р4О2 + О
после чего реакция продолжается :
Р4 + О = Р4O; Р4O + O2 = Р4O2 + О и т.д.
Атомы кислорода, по мнению Семенова, образуются в результате реакции окисления твердого фосфора, идущей на стенках реакционного сосуда. Следовательно, последние могут служить местом зарождения цепей (и обрыва их). Было решено проверить правильность сделанных наблюдений на иных реакциях кислорода: с водородом, оксидом углерода(И), серой. Оказалось, что и эти процессы протекают аналогично реакции окисления фосфора. Стало очевидным, что открыт новый вид химических превращений, получивших название разветвленных цепных реакций. В 1927-1929 гг. Семенов разработал теорию этих реакций, а в 1934 г. вышла его обобщающая монография "Цепные реакции".
Познакомимся с механизмом цепных разветвленных реакций на примере реакции горения водорода. Общее уравнение этой реакции знакомо каждому:
2Н2 + O2 = 2Н2O
Под действием тепла молекулы водорода распадаются на два свободных атома, имеющих неспаренный элек-84
трон (т.е. на два радикала). Они обладают энергией, большей энергии активации реакции, и вступают во взаимодействие с молекулой кислорода:
Н + O2 = ОН + О
Образуются новые активные частицы, которые в свою очередь вступают в реакции:
ОН + Н2 = Н2O + Н-; -О" + Н2 = ОН + Н
Таким образом, цепная реакция все время разветвляется, число активных центров быстро растет.
Казалось бы, цепные реакции могут продолжаться неограниченно, но на самом деле это не так. Если встретятся два свободных радикала, то образуется неактивная молекула (у нее не будет свободных валентностей, не будет неспаренных электронов), и цепь оборвется. То же происходит, если активные частицы столкнутся со стенками сосуда. Например, атомы Сl и Н (взаимодействие Н2 и Сl2-еще один пример цепной реакции) адсорбируются и дезактивируются на стенках реакционных сосудов. Если к адсорбированному атому Сl приблизится другой атом из реакционного объема, то может произойти их рекомбинация в молекулу Сl2, которая вернется в реакционный объем, при этом восстановятся "реакционные" свойства стенки сосуда. Теперь стала понятна роль инертных газов в цепных реакциях: их молекулы мешают активным частицам подойти к стенкам сосуда, где происходит обрыв цепи.
За исследования в области цепных реакций академику Н. Н. Семенову, а также выдающемуся английскому физикохимику Сирилу Хиншелвуду, детально разработавшему механизм процесса, была присуждена в 1956 г. Нобелевская премия.
А теперь, чтобы закончить рассказ о пневматической химии, познакомимся с открытием инертных газов.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'