
Глава 6. "Сила", соединяющая атомы
Зададимся теперь вопросом: почему атомы соединяются, какие силы их связывают?
Эмпедокл объяснял сочетание элементов друг с другом "любовью" и "ненавистью". Гераклит считал, что соединяться могут только вещества с противоположными свойствами. Эти представления сохранялись долгое время, вплоть до XIII в., когда Альберт Великий создал учение о том, что соединение веществ происходит благодаря сходным свойствам. Для обозначения этих свойств он употреблял термин "химическое сродство", подразумевая под ним причину химического взаимодействия.
С развитием корпускулярной теории взаимодействие корпускул стали объяснять по-новому. Так, Ньютон полагал, что возникновение веществ происходит от притяжения корпускул друг к другу под действием силы, аналогичной силе всемирного тяготения. Однако законы, которым подчиняются взаимодействующие частицы, гораздо сложнее, чем закон всемирного тяготения. Ведь, кроме притяжения' между ними действуют и силы отталкивания, особенно когда корпускулы близко подходят друг к другу.
Такие представления были слишком общими и не годились для объяснения конкретных реакций, интересовавших в то время химиков-практиков, а это в первую очередь были реакции замещения-наиболее часто встречающийся в тогдашней химической практике вид превращений. Например, немецкий химик и технолог Иоганн Глаубер в 1656 г. установил, что серная кислота вытесняет азотную и соляную из их соединений и что кислоты по-разному растворяют металлы.
Таких наблюдений к началу XVIII в. накопилось немало. Обобщая их, французский химик Этьен Жоффруа представил в 1718 г. в Парижскую Академию наук "Таблицу наблюдаемых в химии отношений между различными веществами" ("Таблицу сродства"). Получив соль в результате реакции кислоты с основанием, Жоффруа действовал на нее другой кислотой. Если последняя вытесняла кислоту из соли, значит, она обладала большим сродством к основанию. Существование различных степеней сродства между веществами Жоффруа считал законом, который имеет громадное значение в химии.
Вот некоторые сопоставления из его таблицы:
| Серная кислота | Азотная кислота | Щелоч |
|---|---|---|
| Флогистон | Железо | Серная кислота |
| Едкие щелочи | Медь | Азотная кислота |
| Аммиак | Свинец | Соляная кислота |
| Щелочные земли | Ртуть | Уксусная кислота |
| Железо | Серебро | Сера |
Расположение веществ в столбцах сразу показывает, например, что флогистон обладает большим сродством к серной кислоте, чем аммиак или железо; что железо имеет большее сродство к азотной кислоте, чем свинец; что железо может вытеснять из солей азотной кислоты медь и все следующие за ним металлы и т. д. Таблицы Жоффруа в первой половине XVIII в. получили широкое распространение.
Спустя полвека шведский химик Торберн Бергман создал свою теорию "сродства", применив представления Ньютона для объяснения природы сил "простого избирательного притяжения" (так он назвал "сродство"). Последние действуют на чрезвычайно малых расстояниях между частицами реагентов.
Новый этап в изучении природы взаимодействия вещества начался после появления химической атомистики Дальтона.
В 1851-1852 гг. английский химик Уильям Одлинг, исследуя различные неорганические и органические соединения, отметил, что атомы элементов обладают определенной "емкостью" и могут "удерживать" около себя разное количество атомов других элементов или радикалов (групп атомов). Это свойство получило название "атомности элементов". Под атомностью подразумевали число атомов или радикалов, которые может удерживать данный элемент.
Одлинг распространил понятие "атомности элементов" и на неорганические радикалы, и на атомы. Он предложил обозначать ее штрихами вверху справа от символа элемента: Н', О", Bi'" и т.д., а формулы соединений записывать так:
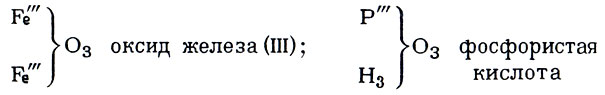
Тогда же проблемой "атомности элементов" занимался другой английский химик, Эдуард Франкланд. В статье "О новом ряде органических тел, содержащих металлы" (1852) он рассматривал соединения металлов (ртути, олова, цинка и др.) с "остатками" органических молекул (радикалами).
При этом он установил следующее:
атомы металлов могут удерживать около себя только строго определенное число радикалов, т. е. соединяться с определенным числом радикалов.
Эти металлоорганические соединения являются производными неорганических веществ, образующимися при замене эквивалентов кислорода радикалами. Например, ZnO - оксид цинка и от него Zn(С2Н3) - метилцинк; SnO-оксид олова и Sn(С4Н5) - этилолово и т.д. (здесь атомная масса кислорода была принята равной 8, а углерода-6). На основании этого, считал Франкланд, сродство элементов, т. е. "соединительная сила", всегда "удовлетворяется" одним и тем же числом присоединяющихся атомов, независимо от их химической природы.
Так работами английских ученых было положено начало учению о валентности. Сам термин "валентность" образован от латинского valentia-сила; впервые его употребил в 1867 г. знаменитый немецкий химик Август Кеку-ле, которому принадлежит важная роль в развитии учения о валентности. Еще в 1857 г. он сформулировал положение, что по основности (атомности, или, что то же, валентности) элементы подразделяются на три группы:
1) одноосновные, или одновалентные, например Н, О, Вг, К;
2) двухосновные, или двухвалентные, например О, S;
3) трехосновные, или трехвалентные, например N, P, Al.
Через год Кекуле установил четырехатомность углерода, исходя из того, что атом углерода "связывает" всегда только четыре атома одновалентного элемента или два атома двухвалентного элемента (следовательно, углерод четырехвалентен). При этом Кекуле считал валентности элементов постоянными, хотя в то время существовала и другая точка зрения.
В том же 1858 г. появилась работа шотландского химика Арчибальда Купера "О новой химической теории", в которой была высказана идея о том, что элементы могут обладать переменной валентностью. Так, углерод по отношению к кислороду может быть двух- и четырехвалентным, образуя соответственно оксиды СО и СO2 . В целом же он признавал, что валентность - "фундаментальное свойство" элементов, определяющее их "химический характер".
Эти представления были подтверждены через шесть лет итальянским химиком Альфредом Наке, который установил, что сера, селен и теллур могут быть четырехвалентными, а не только двухвалентными, как считал Кекуле.
Но чем же обусловлена валентность? Истинная природа химической связи начала проясняться после того, как был открыт электрон. Тут следует назвать имена английского физика Крукса (он открыл катодные лучи), ирландского ученого Джорджа Стоуни (он ввел термин электрон для обозначения единицы электрического заряда, как положительного, так и отрицательного), немецкого геофизика Эмиля Вихерта, который в 1891 г. установил, что электрон в 1000-2000 раз легче атома водорода. Приоритет открытия электрона принадлежит Дж. Дж. Томсону, поскольку именно его количественные эксперименты, выполненные в том же году, окончательно доказали, что катодные лучи состоят из частиц (электронов), которые значительно легче атомов.
Итак, наличие электронов (этим термином в дальнейшем стали обозначать лишь отрицательные заряды) в атомах было доказано. На основании этого немецкие ученые Рихард Абегг и Генрих Бодлендер предложили систематизировать неорганические вещества по сродству элементов к электрону. Они отметили, что в периодах системы Д. И. Менделеева (к тому времени общепризнанной) слева направо это сродство увеличивается, т. е. усиливается электроотрицательность, а в группах сверху вниз возрастает электроположительность.
Абегг в работе "Сродство и валентность" (1904) ввел понятие об электровалентности в ионных соединениях (валентность, измеряемая числом зарядов ионов). По Абеггу, каждый элемент может иметь как положительную, так и отрицательную валентность, и сумма этих валентностей всегда равна восьми. При этом число положительных единиц валентности элемента соответствует номеру группы периодической системы элементов, в которой он расположен.
В том же году немецкий физик П. Друде определил отрицательную валентность как способность атома "отрывать" и "удерживать" около себя электроны других атомов.
Вначале XX в. было предложено несколько моделей строения атома. Одной из первых была модель французского ученого Ж. Перрена, согласно которой положительное ядро окружено электронами, двигающимися "по определенным орбитам". Английский физик В. Кельвин считал, что атом состоит из положительного заряда, в который как бы вкраплены электроны. Были и другие модели, но все они не могли объяснить, в чем причина периодичного изменения свойств химических элементов. В 1904-1907 гг. Джозеф Томсон высказал такое предположение: "корпускулы" (так он называл электроны) располагаются в виде концентрических колец (слоев) внутри положительно заряженной шаровой сферы. Число электронов в кольце возрастает пропорционально его радиусу. Свойства атомов, состоящих из подобным образом построенных колец, имеют много общего. Причиной периодического изменения свойств химических элементов являются особенности расположения электронов по мере увеличения атомных весов.
На внешнем (самом дальнем от центра) кольце находятся подвижные "корпускулы" в количестве до восьми. Они-то и участвуют в образовании связей между атомами. Электроположительная валентность элемента равна числу таких подвижных электронов, которые переходят к другому атому. Электроотрицательная валентность равна разности между восьмью и числом подвижных электронов, т.е. числу тех электронов, которые атом принял, чтобы установилась устойчивая (восьмиэлектронная) оболочка. Таким образом, соединение атомов в молекулу осуществляется за счет перехода электронов, поскольку при этом образуются электроположительные и электроотрицательные атомы, притягивающиеся друг к другу.
Позднее (1915) немецкий физик И. Штарк ввел специальное понятие о "валентных электронах", подразумевая под ними электроны внешнего слоя, которые в реакциях переходят от одного атома к другому.
Соотечественник и коллега Штарка Вальтер Коссель, рассматривая неорганические полярные соединения, пришел к выводу, что взаимодействие атомов сводится к передаче электронов. Он предложил (1916) следующую теорию. Электроны в атомах располагаются по оболочкам, причем предпоследняя (начиная с лития) соответствует электронной оболочке предшествующего инертного газа (у лития на ней два электрона, как и у гелия). С каждым новым периодом появляется новая оболочка, которая постепенно заполняется электронами до устойчивой конфигурации "инертной" оболочки. В реакциях атомы, содержащие на последней валентной оболочке малое число электронов, отдают их тем атомам, у которых эта оболочка близка к завершению, т.е. атомы стремятся к устойчивому состоянию инертного газа. Образуются положительно и отрицательно заряженные ионы, которые, соединяясь, дают электронейтральную молекулу. Таким образом, если атом отдает электроны, то возникает положительная валентность, равная числу потерянных электронов; присоединение электронов ведет к отрицательной валентности, равной числу полученных электронов.
А как же определить валентность в неполярных соединениях? В 1916 г. американский физикохимик Гилберт Льюис в статье "Атом и молекула" выдвинул теорию ковалентной (гомеополярной) связи. Он опирался на следующие постулаты:
1) атом имеет ядро, остающееся неизменным "при всех обычных химических процессах" и обладающее "некоторым избытком положительных зарядов", численно равным номеру группы периодической таблицы, в которой расположен элемент;
2) кроме ядра атом имеет оболочки, содержащие электроны, число которых "изменяется при изменении химической природы атома от 0 до 8", а если атом нейтрален, то их число "равно избытку положительного заряда ядра";
3) атом обычно "имеет тенденцию - содержать четное число электронов в оболочке";
4) две электронные оболочки "взаимно проницаемы";
5) электроны могут "переходить из одного положения в наружной оболочке к другому", но обычно "удерживаются в своем положении" напряженными связями, прочность которых "определяется природой данного атома и атомов, соединенных с ним".
Электронные пары, за счет которых соединяются атомы, Льюис обозначал двумя "вертикальными" точками, например
Н:Н; Н:O:Н
Валентность элемента соответствует числу общих электронных пар.
Итак, теперь легко было установить валентность элементов в ионных и ковалентных соединениях, но... не всегда! Вот, например, эмпирическая формула хлороплатината калия K2PtCl6 (ее можно записать и так: 2КСl ⋅ PtCl4) или такого соединения: Pt(NH3)4Br4. Какова валентность платины в этих случаях? Такие соединения (их называют комплексными) были известны еще в конце XIX в. Для объяснения их строения немецкий химик Альфред Вернер предложил координационную теорию, которую он изложил в статье "О строении неорганических соединений" (1893). Суть этой теории в следующем: в центре молекулы находится атом какого-либо элемента (обычно металла), который играет роль комплексообразователя. Он притягивает к себе (координирует) отдельные атомы или группы атомов, обладающих химической устойчивостью и непосредственно связанных с центральным атомом (они получили название лигандов). Те же атомы или группы атомов, которые отличаются химической подвижностью, находятся на большем расстоянии от центрального атома и экранированы от него лигандами; в водной среде они отщепляются в виде ионов. Следовательно, по Вернеру, комплексные соединения состоят из двух сфер - внутренней, включающей центральный атом и лиганды, и внешней, соединенной с внутренней сферой ионной связью. Внутренняя сфера заключается в квадратные скобки:
K2[PtCl6] и [Pt(NH3)4Br2]Br2
Вернер допускал, что при образовании комплексных соединений центральные атомы проявляют, помимо основной (главной), еще и побочную валентность: "Причина... способности атомов к дальнейшему присоединению заключается в том, что в них кроме главных валентных сил имеются еще силы-силы побочной валентности". Между силами главной и побочной валентности нельзя провести резкую границу, поскольку они "близки друг к другу и, может быть, даже идентичны".
Побочные валентности изображаются пунктирными линиями :
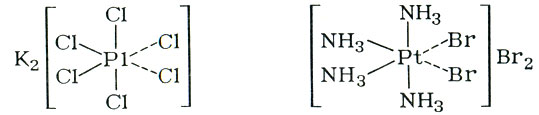
Как мы видим, у платины в этих соединениях главная валентность равна четырем.
Вернер считал, что без привлечения понятия "побочной валентности" нельзя обойтись "в настоящий переходный период учения о валентности". Таким образом, элементы кроме главной валентности в некоторых (комплексных) соединениях обладают и побочной валентностью.
Но не только комплексные соединения доставили
много хлопот химикам. В 1951 г. Р. Посон и Т. Кили получили необычное соединение железа - ферроцен (дициклопентадиенилжелезо). Его молекула состоит из двух плоских параллельных циклопентадиенильных колец, между которыми на равном от них расстоянии находится атом железа. Такие соединения стали называть сэндвичевыми (они и впрямь напоминают "бутерброд"). Атом железа в ферроцене связан с... десятью равноценными атомами углерода! Не считать же железо десятивалентным !
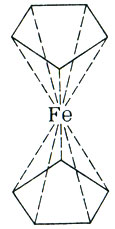
Как показали исследования, атом железа в ферроцене формально имеет валентность 2 +. Формально... А на самом деле? На этот вопрос наука пока не дает окончательного ответа. Словом, учение о валентности продолжает разрабатываться.
Непосредственно с валентностью связаны понятия об электроотрицательности и степени окисления.
Под электроотрицательностью элемента понимают относительную способность его атомов притягивать электроны. Это понятие введено в 1932 г. американским ученым, дважды лауреатом Нобелевской дремии Лайнусом Полингом. Он дал ей количественную характеристику, сопоставляя энергию связи между двумя разными атомами в молекуле (например, HF) со средним значением энергий связи в молекулах соответствующих простых веществ (в нашем примере Н2 и F2). Если бы в молекуле HF была чисто ковалентная связь, как в молекулах Н2 и F2, то, видимо, энергия связи в HF была бы близка к среднему значению из энергий связи в молекулах Н2 и F2. Но на самом деле она почти вдвое больше среднего арифметического из этих значений. Такая "избыточная" энергия приписывается частично ионному характеру связи в HF, что обусловливается различной электроотрицательностью атомов Н и F.
Существует несколько шкал электроотрицательности (Полинга, Малликена, Сандерсона и др.). По шкале Полинга наибольшая электроотрицательность у фтора (4), наименьшая-у цезия (0,7). Но какая бы шкала ни была, в ней отчетливо прослеживается периодичность: с увеличением порядкового номера в периодах электроотрицательность возрастает, а в подгруппах - уменьшается. Зная величину электроотрицательности, можно предсказать характер связи: при разности электроотрицательностей больше 2,0 связь считается ионной; при разности 0,4-2,0 связь ковалентная с частично ионным характером и при разности меньше 0,4-чисто ковалентная.

Лайнус Полинг (род. 1901)
С электроотрицательностью связана и степень окисления. Это понятие введено для характеристики состояния атома в химических соединениях. При образовании сложных веществ происходит смещение (полное или частичное) электронов от одних атомов к другим, оно и определяет степень окисления (английский термин oxydation number). По определению Полинга, она выражает величину электрического заряда данного атома при допущении, что произошло перераспределение электронов между атомами в соединении, т. е. последние состоят как бы из положительно и отрицательно заряженных ионов. Степень окисления - это условный заряд атома в соединении, определяемый на основании предположения, что оно состоит из ионов.
Всем атомам элементов, находящихся в виде простых веществ, приписывается степень окисления, равная нулю (Сu0, Н02, Р04); в сложных веществах атомам, которые отдают электроны, приписывается положительное значение степени окисления, атомам же, принимающим электроны,-отрицательное. Степень окисления одноатомного иона (в ионном соединении) равна электрическому заряду этого иона (К+Сl-, Сu+2Сl-2). В ковалентном соединении степень окисления равна заряду, который остается на данном атоме после отнесения общих электронных пар к более электроотрицательному атому:
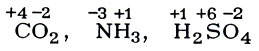
Алгебраическая сумма степеней окисления всех атомов в соединении равна нулю.
Нельзя отождествлять понятия "степень окисления" и "валентность", даже если их значения совпадают. Например, валентность хлора в С12 и в НС1 равна 1, в то время как его степень окисления в этих соединениях равна соответственно 0 и - 1. Заметим тут же, что заряд хлора в молекуле НС1 равен на самом деле - 0,13. Таким образом, если понятие "валентность" является в химии фундаментальным, то "степень окисления" - понятие формальное, вспомогательное.
При чтении последних глав не раз встречалось выражение "периодически изменяются". Что же под этим понимают в химии? Об этом пойдет речь в следующей части.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'