
Глава 5. Закон Менделеева и строение атома
Многие ученые пытались выявить физические основы периодического закона. Одну из первых попыток в этом отношении предпринял шведский ученый И. Ридберг, который заметил (1885), что связь между химическими свойствами элементов и их атомной массой не всегда однозначна. Почему? Не все элементы в периодической системе расположены в порядке возрастания атомных масс (вспомним хотя бы пары Со - Ni; Те - I). Чем же в таком случае определяется положение элемента в периодической системе? Ответить на этот вопрос помогли такие события в науке, как открытие рентгеновских лучей (1895), радиоактивности (1896), электрона и т.д., а также разработка атомных моделей Э. Резерфордом и Н. Бором-выдающимися физиками нашего века.
В 1911 г. Эрнст Резерфорд предложил свою модель строения атома, получившую название планетарной, так как она напоминала строение Солнечной системы в миниатюре. В центре атома находится положительно заряженное ядро, а вокруг него по неким траекториям-орбитам движутся электроны. Через два года планетарная модель была усовершенствована Нильсом Бором. Он предположил, что электроны вращаются не по любым орбитам, а только по определенным, которые можно сгруппировать в отдельные оболочки (электронные оболочки). Бор обозначил их (начиная от ядра) латинскими буквами К, L, M, N, О, Р, Q. На этих оболочках должно находиться определенное число электронов, которое равно 2n , где и--номер оболочки. Например, для первой оболочки К (n = 1) 2n2 = 2; для L (n = 2) 2n2 = 8; для М (n = 3) 2n2 = 18 и т.д. Оболочки в свою очередь могут состоять из подоболочек, на которых также находится определенное число электронов (Бор не знал еще, сколько именно).
В том же 1913 г. голландский физик А. Ван ден Брук предположил, что число положительных зарядов в атоме равно порядковому номеру элемента в периодической системе. Но как это доказать?
Ждать пришлось недолго: уже в следующем году доказательство было представлено учеником Резерфорда Генри Мозли. К этому времени было известно, что при бомбардировке электронами различных элементов образуются два вида рентгеновских лучей. У одного вида излучения длины волн зависят от скорости бомбардирующих электронов, у второго - только от природы элемента-мишени. Последнее излучение было названо характеристическим. Исследовать эти лучи Резерфорд поручил Мозли. В 1913 г., используя в качестве антикатода элементы ряда кальций-никель, молодой ученый установил, что чем больше атомная масса элемента, тем меньше длина волны характеристических рентгеновских лучей, а сами длины волн укладываются в ряд последовательных чисел. Другими словами, длины волн закономерно изменяются при переходе от одного элемента к другому. В следующем году Мозли продолжил свои исследования для элементов от алюминия до серебра. В результате этих работ был установлен следующий закон (закон Мозли):
квадратные корни из обратных значений длин волн
находятся в линейной зависимости от порядкового
номера элементов.
Мозли определил заряды ядер и порядковые номера для всех известных тогда элементов и установил, что численные значения порядкового номера и заряда ядра совпадают. Он также показал, что элементы с порядковыми номерами 43, 61, 72, 85, 87 и 91 еще предстоит открыть.
Таким образом было установлено, что свойства элементов можно рассматривать как функцию порядкового номера, или, что то же самое, заряда ядра. При этом если размещать элементы в порядке увеличения заряда ядра, то никаких исключений не будет! Так, у кобальта заряд ядра + 27, а у никеля + 28; у теллура он равен + 52, а у иода + 53. Тем самым Мозли подтвердил правильность расположения элементов в периодической системе Д. И. Менделеева.
Учитывая все эти открытия, Ни лье Бор в 1921 г. установил связь между периодичностью свойств элементов и периодичностью заполнения электронных оболочек. С увеличением порядкового номера элемента периодически повторяется заполнение электронами внешних электронных оболочек. Но, как мы помним, каждая оболочка состоит из подоболочек, число которых равно номеру оболочки; у первой-одна подоболочка, у второй-две, у третьей-три и т.д. Они обозначаются строчными латинскими буквами: s, р, d, f. Каждая подоболочка вмещает не более определенного числа электронов: s-не более двух, р-не более шести, d-не более десяти, f-не более четырнадцати.
Боровская модель электронного строения атома позволяет объяснить химические свойства элементов. Так, у всех щелочных металлов на внешней оболочке один s-электрон, который легко отщепляется, и атомы щелочных металлов превращаются в ионы, имеющие весьма устойчивую электронную структуру атома ближайшего инертного газа. А редкоземельные элементы? У них идет заполнение глубоколежащей 4f-подоболочки, которая практически не участвует в образовании химических связей. Следовательно, химические свойства этих элементов зависят от трех наружных электронов-двух 6s-элек-тронов и одного 5d-электрона (впервые появившегося у лантана). Вот почему все редкоземельные элементы обычно трехвалентны и очень похожи друг на друга.
Бор предсказал, что неоткрытый элемент № 72 не может быть редкоземельным элементом, а должен являться аналогом циркония, поэтому и искать его надо в минералах циркония. Этому совету последовали голландский физик Дирк Костер и венгерский химик Дьердь Хевеши. В январе 1923 г. они сообщили о новом элементе, обнаруженном в циркониевых минералах; они назвали его гафнием (Гафниа-древнее имя Копенгагена).
Через два года был открыт элемент № 75-рений. Оставались неизвестными еще четыре элемента: № 43, № 61, № 85 и № 87, и тогда вся периодическая система будет заполнена. Почему же они так долго не были открыты? Многие ученые считали, что эти элементы не образуют своих минералов, а входят в виде примесей в состав минералов других элементов. Их там и искали, но безрезультатно. А может быть, они радиоактивны? Если это так, то как долго живут их изотопы? Где их можно обнаружить? Конец такого рода размышлениям положили итальянские ученые-физик Э. Сегре и химик К. Перрье.
Сегре знал, что при работе циклотрона молибденовая деталь, направляющая поток заряженных ускоренных частиц на мишень, поглощала часть таких частиц. Ясно, что при этом проходили ядерные реакции. Молибден-сосед элемента № 43, и, следовательно, при поглощении дейтронов (ядер дейтерия) могли образоваться изотопы циркония, ниобия, молибдена и его неоткрытого соседа. Проведя химические исследования молибденовой пластинки, облученной дейтронами, ученые установили, что наблюдаемая радиоактивность может быть связана только с изотопом элемента № 43. Это произошло в 1937 г. Новый элемент назвали технецием (от технетос-искусственный), желая показать тем самым способ его открытия. Синтез технеция оказался первой ласточкой в целой серии подобных синтезов элементов.
Через два года был получен франций (элемент № 87), а еще через год астат (элемент № 85), названный так за свою неустойчивость-самый долгоживущий его изотоп имел период полураспада 8,3 часа. В периодической системе элементов оставалась одна пустая клеточка под № 61. Элемент, для которого она была предназначена, получили только в 1945 г. американские ученые Д. Марийский, Л. Гленденин и Ч. Кориэлл. Он был назван прометием.
Если синтезировали элемент № 87, то почему нельзя синтезировать элемент № 93 или 97? Собственно, 93-й элемент был получен... за пять лет до прометия. Долгое время считалось, что элементы, расположенные за ураном (трансурановые), когда-то существовали в природе, но, будучи неустойчивыми, распались и превратились в обычные нерадиоактивные элементы.
В 1932 г. английский ученый Дж. Чедвик открыл нейтрон. По массе он был близок к протону, но не имел заряда и поэтому обладал способностью легко проникать в ядра атомов и вызывать их превращения. Им-то и стали бомбардировать различные элементы, в том числе и уран. Возглавлявший группу исследователей итальянский физик Энрико Ферми, облучив уран нейтронами, обнаружил новый вид радиоактивности. Видимо, уран-238, захватив нейтрон, превращался в изотоп урана-239, который из-за избытка нейтронов испытывал (3-распад и превращался в изотоп... элемента 93! Это было в 1934 г. Исследовав по возможности полученный изотоп, Ферми пришел к выводу, что он является аналогом рения.
В том же 1934 г. И. Ноддак высказала мысль, что при бомбардировке урана нейтронами должны образовываться ядра более легких элементов, не трансурановых, так как ядра урана раскалываются. Это и было подтверждено опытами через четыре года. А как же работы Ферми? Он был прав, но доказать это в то время было невозможно. Его мишень состояла из смеси изотопов урана-238 и урана-235. Первый, претерпевая изменения, превращался в изотоп элемента 93, а второй давал изотопы элементов, находящихся в середине периодической системы, что и осложняло всю картину. Как же тогда разделить смесь образующихся ядер? Может быть, по массе-легкие ядра будут отлетать от мишени дальше, а тяжелые (93-го элемента) ближе. Этим и занялся американский физик Е. Макмиллан. Он выделил тяжелую фракцию и обнаружил в ней источник радиоактивности с периодом полураспада 2,3 дня. Но новый ли это элемент? Химик П. Абельсон, приехавший на каникулы к Макмиллану, помог решить задачу. Существование 93-го элемента было доказано. Однако... он не был аналогом рения! Он стал первым трансурановым элементом. Вот реакция его получения:
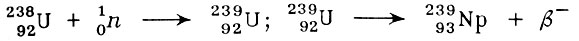
Авторы работы назвали его нептунием по имени планеты Нептун, которая следует за Ураном. Через два года был синтезирован самый долгоживущий изотоп 237Np с периодом полураспада 2,2-106 лет (сейчас известно 15 изотопов этого элемента). Еще через два года были получены "осязаемые" количества элемента - несколько микрограммов. Нептуний-металл серебристого цвета, плавящийся при 637 °С; его плотность 20,45 г/см3. В химическом отношении он менее активен, чем уран, но тем не менее легко вступает в реакции с неметаллами, хорошо растворяется в кислотах и т.д. В соединениях нептуний проявляет переменную валентность от + 3 до +7, т. е. действительно напоминает рений, хотя по электронному строению и не является его аналогом.
Весной 1941 г. американский ученый Глеи Сиборг с сотрудниками получили изотоп следующего трансуранового элемента - плутония 239Ри, который, как оказалось, под действием медленных нейтронов делится более

Георгий Николаевич Флёров (род. 1913)
интенсивно, чем уран-235. В США из плутония была изготовлена бомба, сброшенная 9 августа 1945 г. на японский городок Нагасаки. Ее взрыв унес десятки тысяч человеческих жизней...
В 1944 г. был синтезирован кюрий, через год-америций, через четыре года- берклий, еще через год-калифорний, а в конце 1952-начале 1953 г. в продуктах распада" после ядерного взрыва были обнаружены элементы № 99 и № 100-эйнштейний и фермий.
Вначале 1955 г. в Радиационной лаборатории Калифорнийского университета в Беркли (США) царила суматоха. Пять американских химиков и физиков-Г. Сиборг, А. Гиорсо, Б. Гарвей, Г. Чоппин и С. Томсон-были заняты получением элемента № 101. Исходным материалом служили атомы трансуранового элемента эйнштейния их нужно было подвергнуть бомбардировке ядрами гелия:
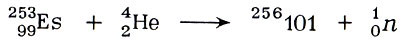
Все казалось просто, кроме одного: чем больше порядковый номер элемента, тем он более неустойчив и тем меньше период его полураспада. Для элемента № 101 он должен был равняться примерно получасу. Как успеть за это время идентифицировать элемент? Ученые буквально вынуждены были заниматься "химией на бегу"... Новому элементу было дано имя великого русского химика Д. И. Менделеева - менделевий, Md.
Для обоснования положения трансурановых элементов в периодической системе Г. Сиборг предложил (1944-1945) актиноидную теорию. Согласно этой теории в атомах следующих за актинием элементов идет заполнение 5f-подоболочки, т.е. так же, как у лантаноидов это происходит с 4f-подоболочкой. Образуется новое семейство актиноидов. Оно похоже на семейство лантаноидов, так как и в том и в другом случае проявляется одинаковая степень окисления ( + 3). Но... оказалось, что некоторые актиноиды проявляют иную степень окисления: у менделевия она может быть + 1, у эйнштейния, фермия, менделевия устойчивая степень окисления + 2, а у нептуния, плутония и америция она может быть + 7. Словом, актиноиды обладают своеобразными свойствами. Это обусловлено тем, что энергии связи подоболочек 5fи 6d близки и их электроны могут участвовать в образовании химических связей. Кроме того, с увеличением заряда ядра усложняется характер взаимодействия электронов в атомах. Таким образом, сравнение актиноидов и лантаноидов носит несколько формальный характер. Но вернемся к синтезу элементов.
Менделевием закончился первый этап получения подобных элементов путем бомбардирования легкими частицами. Но чем выше порядковый номер актиноида, тем реже происходит захват частиц (нейтронов или ядер гелия) - для этого нужны месяцы и годы, а сами элементы живут часы. Нужен был принципиально новый путь синтеза. Его предложили советские ученые, работающие в Лаборатории ядерных реакций Объединенного института ядерных исследований (ЛЯР ОИЯИ), в подмосковном городке Дубне. Руководит этой лабораторией Герой Социалистического труда, лауреат Ленинской и Государственной премий академик Георгий Николаевич Флёров. Вот как он пишет об этом:
"После долгих дискуссий, детальных обсуждений с И. В. Курчатовым выбор пал на проблему синтеза новых далеких трансурановых элементов". И далее: "У американских физиков уже был накоплен теоретический и экспериментальный задел по созданию линейных ускоряющих систем. Поэтому решено было идти своим путем: конструировать циклотрон для ускорения тяжелых ионов с параметрами лучшими, чем у линейных ускорителей". В 1960 г. циклотрон уже работал на полную мощность.
Пять лет (с 1957 по 1962 г.) дубненские ученые вели наступление на 102-й элемент, окончившееся победой - при обстреле плутониевой мишени ионами кислорода был получен изотоп нового трансуранида:

Он был назван жолиотием (в честь Ф. Жолио-Кюри), однако американские исследователи, также работавшие над синтезом 102-го элемента, дали ему имя нобелий.
Через два года в Дубне осуществили синтез 104-го элемента, который должен был быть аналогом гафния. Для опыта выбрали реакцию

Тонкий слой плутония-242 был нанесен на алюминиевую фольгу, и эту мишень бомбардировали ускоренными ионами неона. Образовавшиеся ядра вылетали из мишени и попадали па никелевую ленту-транспортер, которая выносила их из области облучения. Лента двигалась вдоль стеклянных детекторов, и при спонтанном делении осколки ядер оставляли след на стекле, который после специальной обработки становился видимым в микроскоп. За 1000 часов облучения было получено около 150 ядер нового элемента с периодом полураспада 0,3 с.
Для химической идентификации 104-го элемента была использована разница в свойствах высших хлоридов элементов III группы (в которую входят актиноиды), IV группы (к которой должен принадлежать 104-й элемент) и V групп периодической системы. В отличие от высших хлоридов IV и V групп хлориды элементов III группы нелетучи. В отличие от хлоридов IV группы хлориды элементов V группы взаимодействуют с хлоридами щелочных металлов, образуя комплексные соединения типа К[ТаСl6].
Работа, проведенная под руководством молодого чехословацкого химика Иво Звары, однозначно показала, что 104-й элемент принадлежит к IV группе и является аналогом гафния.
1 июня 1966 г. на Международном ученом совете Объединенного института ядерных исследований было заслушано сообщение об открытии нового элемента и предложено название курчатовий (Кu)-в честь выдающегося советского физика Игоря Васильевича Курчатова.
С 1968 г. в Дубне под руководством Г. Н. Флёрова начались работы по синтезу 105-го элемента. В основу была положена реакция:
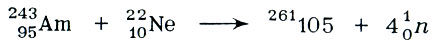
В 1970 г. ученые определили основные свойства этого элемента-он оказался аналогом тантала. Его назвали нилъсборий (Ns). Затем последовал синтез 106-го, 107-го элементов... А сейчас, когда впервые в мире в Объединенном институте ядерных исследований получены ускоренные пучки ионов кальция-48, стала реальной мечта ученых синтезировать элемент № 114, который должен быть наиболее стабильным из всех ранее полученных. Почему?
С середины 30-х гг. в науке возникло представление о ядерной (нуклонной) периодичности. Как электроны в атоме, так и нуклоны (протоны и нейтроны) в ядре образуют оболочки, которые также постепенно заполняются. Наиболее стабильны те ядра, у которых 2, 8, 20, 50, 82, 126 нейтронов или протонов, а также те, у которых 114 протонов или 184 нейтрона. Эти числа получили название магических. Устойчивость таких ядер еще не получила полного объяснения.
Для синтеза первого, сравнительно стабильного изотопа 114-го элемента и предполагают использовать реакцию

Синтез трансурановых элементов продолжается... А есть ли предел ему? И вообще, где границы периодической системы?
Прежде всего несколько слов о нижней границе. Казалось бы, что тут особенного, она проходит по водороду. А вот где его поместить: в первой ли группе или в седьмой? До сих пор нет единого мнения. Его помещают то там, то здесь. И вот почему.
Менделеев определил водороду место в первом периоде и первой группе, так как рассматривал его как легкий аналог щелочных металлов. И современная наука подтверждает это. Как и щелочные металлы, водород имеет один валентный электрон, превращается в одновалентный катион, вытесняет ряд металлов из оксидов и солей. В химическом отношении водород обнаруживает некоторое сходство с щелочными металлами. Но, с другой стороны, водород может превращаться в анион Н - (этой способностью не обладают щелочные металлы, но обладают галогены); до завершения устойчивой оболочки ему недостает одного электрона (как у галогенов); он неметалл, образует двухатомные молекулы (как галогены).
Двойственность свойств водорода определяется особенностью строения его атома-один протон и один электрон. Потеряй водород электрон, и останется протон-частица, а не атом. Но где бы он ни находился-в группе I или VII, нижняя граница периодической системы "проходит" по этому элементу.
А где же верхняя граница системы? Как далеко ее можно сдвигать? Сколько всего элементов? 115? 120? Должен ли быть конец?
Различают верхнюю естественную и верхнюю искусственную границы. Первая проходит по самому тяжелому элементу, найденному в природе. Это уран. Искусственная же граница определяется последним синтезированным на сегодняшний день трансурановым элементом. Здесь все сложнее.
Прежде всего нужно учитывать трудность эксперимента и то, что с увеличением порядкового номера трансуранового элемента период жизни его наиболее стабильного изотопа резко сокращается. Однако вспомним: мы уже говорили о возможной относительной стабильности изотопов 114-го и 126-го элементов-этих своеобразных островов устойчивости. Проделанные расчеты показывают, что элементы с порядковыми номерами (числом протонов) 164 и 184 и с числом нейтронов 196 будут также довольно устойчивы. Будущее покажет, насколько верны такие прогнозы, а пока верхняя граница периодической системы имеет неопределенные очертания.
Теперь обратимся к элементам, которые сравнительно хорошо изучены.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'