
Глава 6. Неметаллы
В периодической системе элементов Д. И. Менделеева неметаллы составляют только 1/5 часть (22, считая астат), но по распространенности в нашей Вселенной на долю их атомов приходится более 99,9%. Неметаллы играют исключительную роль в жизни человека, животных, растений-достаточно вспомнить о водороде, кислороде, азоте. Не меньшее значение имеют и другие неметаллы: углерод, кремний, фосфор, сера. Рассказ о неметаллах начнем с элементов IV группы.
IV группа. Первым стоит углерод. Атом его имеет электронное строение 2s22p2, т.е. на внешней оболочке находится четыре валентных электрона; этим и обусловлена способность образовывать прочные ковалентные связи, которые характерны для соединений углерода (только с наиболее электроположительными металлами углерод дает ионные соединения, например карбиды СаС2, Аl4С3). Углерод дает, как никакой другой элемент, разнообразнейшие соединения благодаря тому, что его атомы могут соединяться друг с другом, образуя цепи, кольца (циклы), разветвленные структуры. Это органические соединения, которых насчитывается несколько миллионов, в то время как неорганических соединений всего около 70 тысяч. Углерод имеет два стабильных изотопа: 12С и 13С (соответственно 98,89 и 1,11%). В верхних слоях атмосферы образуется третий, но уже радиоактивный изотоп 14С из изотопа 14N при действии на последний космических нейтронов по реакции
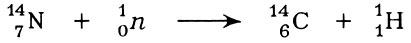
Период полураспада 14С составляет 5600 лет. На каждый миллиард молекул атмосферного СO2 приходится одна, содержащая атом 14С, которая вместе с другими также поглощается растением в процессе фотосинтеза, а потом попадает в организм животного или человека. После гибели организма возможен только распад 14С. Через 5600 лет его останется половина, еще через 5600 лет-половина от половины и т.д. Значит, по количеству 14С в породах, остатках живых организмов и т. д. можно судить об их возрасте? Такой метод-своеобразные "углеродные часы" - предложил американский ученый У. Либби; в 1960 г. он был удостоен Нобелевской премии.
Элементный углерод образует аллотропные модификации (видоизменения). Аллотропия -это способность химических элементов существовать в виде различных простых веществ. Впервые это явление было обнаружено в XVIII в. у углерода, когда доказали, что при сгорании обычного угля и алмаза образуется один и тот же газ - углекислый. Значит, и уголь, и алмаз состоят из одного и того же элемента-углерода. До 1960 г. считалось, что у углерода только две аллотропные модификации - алмаз и графит (древесный уголь, сажа, кокс являются разновидностями графита).
Чистый алмаз, как известно, хороший изолятор. Но вот в 1952 г. английский физик Дж. Кастерс установил, что голубые алмазы являются полупроводниками. Поскольку природных алмазных полупроводников добывалось очень мало, их стали получать искусственным путем. Для этой цели в кристаллическую решетку алмаза вводят бор, бериллий и алюминий. Алмазные полупроводники, обладающие большой теплопроводностью, теплостойкостью и электрической прочностью, начинают использоваться в электротехнике.
Новые области применения получил и графит. Особо высокочистый, он является хорошим замедлителем нейтронов и используется в реакторостроении. На основе графита созданы графитопласты - пластмассы, в которых графит содержится в качестве наполнителя; например, ангемит - пластмасса, вырабатываемая из фенолофор-мальдегидной смолы и графита, обладает высокой теплостойкостью и антикоррозионными свойствами.
В 1960 г. в Государственный реестр открытий СССР под № 107 (с приоритетом от 4 ноября) была внесена запись: "Экспериментально установлено не известное ранее явление существования новой кристаллической формы углерода-карбина, характеризующейся, в отличие от алмаза и графита, цепочечным (линейным) строением углеродных макромолекул". Эта новая, третья аллотропная модификация углерода была получена советскими учеными В. В. Коршаком, А. М. Сладковым, В. И. Касаточкиным и Ю. П. Кудрявцевым в Институте элементоорганических соединений АН СССР.
По внешнему виду карбин представляет собой черный порошок. Карбин - цепочечный полимер, у которого атомы углерода располагаются в цепь и связываются друг с другом чередующимися одинарными и тройными связями:
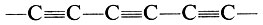
После того как карбин был получен в лаборатории, его обнаружили в метеоритном кратере Рис (ФРГ) и в метеорите Новый Урей (СССР). Это наводит на мысль, что карбин образуется в специфических условиях, изучение которых поможет разгадать тайны космохимии. Карбин обладает полупроводниковыми свойствами, и под действием света его проводимость повышается. Поэтому первое применение он нашел в фотоэлементах.
Позднее был получен другой линейный полимер углерода с двойными связями:
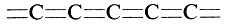
Он получил название поликуму лен. Считают, что это новая форма карбина (хотя есть мнение, что он является четвертой модификацией углерода).
Через два года после открытия карбина академик В. А. Каргин с сотрудниками, изучая сажевые частицы, обнаружил, что некоторые их них отражают, словно зеркало, световые лучи. Эти частицы получили название зеркальный углерод. Он обладает необычной структурой. Это трехмерный полимер, упакованный настолько компактно и прочно, что образуется очень стабильная структура: зеркальный углерод не переходит в графит при температуре, когда алмаз превращается в графит. А ведь строение графита и зеркального углерода аналогичное - слоистое. В чем же дело? Отдельные слои графита связываются слабыми межмолекулярными силами, которые легко разрываются; у зеркального же углерода связи между слоями химические, а значит, и более прочные.
Зеркальный углерод обладает гладкой поверхностью, он тверд, устойчив к температурным воздействиям, непроницаем для газов и жидкостей и ... биологически совместим с живыми тканями. Но он очень хрупок.
Чтобы повысить прочность зеркального углерода, в него вводят углеродные нити - образуется углерод, упрочненный углеродным волокном (УУУВ). Такой УУУВ прошел экспериментальную проверку в медицинской технике: стержни, спицы и сердечные клапаны из него хорошо срастались с тканями, не вызывали инфекции, не давали осложнений. Проводятся опыты по использованию УУУВ в производстве тормозов, подшипников и т.д.
Ближайший аналог углерода по группе -кремний. У него также на внешней электронной оболочке 4 электрона: два s и два р, а поэтому в большинстве соединений кремний четырехвалентен. Как и атомы углерода, атомы кремния образуют цепи, но очень короткие (до 8 атомов), так как энергия связи Si-Si почти вдвое меньше, чем у связи С-С, причем атомы кремния могут связываться между собой только одинарной связью. Зато энергия связи Si-О значительно выше, чем энергия связи С-О, поэтому соединения кремния с кислородом очень устойчивы, например силикаты
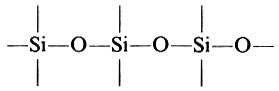
И если углерод - основа всего живого, то кремний-своеобразный "скелет" Земли. Он встречается в природе только в виде различных соединений, главным образом кремнезема SiO2. Песок и граниты, глины и песчаники, гнейсы и сланцы-все это соединения кремния. Они простираются в глубь земной коры до глубины 20 км и создают ту основу, на которой покоятся океаны и моря, леса и степи, горы и пустыни. Природные соединения кремния имеют почти тот же возраст, что и наша планета. Однако с кремнием в свободном виде человек познакомился только в 1811 г., когда Ж. Гей-Люссак и Л. Тенар выделили его, хотя не установили, что имеют дело с новым элементом. Через 12 лет Берцелиус, нагревая фторсиликат калия с калием
K2SiF6 + 4К = 6KF + Si
получил такой же продукт и указал, что это новый элемент. Латинское название элемента silicium происходит от слова silex-кремень, твердый камень. Русское название "кремний" впервые ввел Г. И. Гесс в 1834 г.
Соединения кремния - непременная составная часть стекла, керамики, фарфора, цемента и других строительных материалов. В последние десятилетия интенсивно развивается важная область применения кремния - радиоэлектроника, где необходим особо чистый кремний (на 1 миллиард атомов кремния 1 (!) атом примеси); его получают, восстанавливая тетрахлорид кремния парами цинка. Только такой кремний применяется в изготовлении полупроводников, выпрямителей и т.д. Солнечные батареи, преобразующие энергию Солнца в электрическую, незаменимы на искусственных спутниках Земли, космических кораблях. Кремниевые выпрямители широко распространены на электроподстанциях железных дорог для преобразования переменного тока в постоянный, который используется в тяговых электродвигателях. В больших количествах кремний применяется при получении различных сплавов, его добавки повышают устойчивость к коррозии и прочность, улучшают литейные свойства. Его применяют для поверхностного легирования металлов, отчего увеличивается их устойчивость к коррозии при высоких температурах.
Но кремний играет важную роль не только в неживой природе. Его оксид служит основой для построения скелетов многих морских организмов (диатомеи, радиолярии, фораминифоры, некоторые морские звезды и губки).
Жесткость стеблей многих растений (осока, бамбук) зависит от содержания в них кремния. Ортокремниевый эфир холестерина содержится в перьях птиц; молекулы белка каротина в эпителии кожи "сшиты" друг с другом не только атомами серы, но и кремния. Медикаменты, содержащие элемент № 14, начинают входить в фармацевтическую практику. А в 1975 г. советские исследователи под руководством М.Г. Воронкова обнаружили кремний в составе... ДНК и РНК некоторых видов живых организмов. Какова его роль в генетическом аппарате, пока не ясно.
Кремний входит в состав полиорганосилоксанов-кремнийорганических соединений, впервые полученных в 1937г. советским химиком, академиком К.А.Андриановым. На их основе получают различные термостойкие каучуки, лаки и т.д.
V группа. Соседями углерода и кремния справа являются неметаллы V группы-азот, фосфор и мышьяк. Структура внешней электронной оболочки их атомов одинакова: два s- и три р-электрона, т.е. высшая степень окисления + 5, а низшая - 3.
Азот-газ, типичный неметалл, не имеющий аллотропных видоизменений; фосфор-тоже неметалл, но уже имеющий несколько аллотропных модификаций, из которых черный фосфор обладает свойствами полупроводника; для мышьяка же характерны металлический блеск и электропроводность кристаллов.
Об азоте мы рассказывали в главе "Мефитический воздух", а сейчас пойдет речь о фосфоре. Его название происходит от слов фос-свет и форос-несущий, т.е. "несущий свет", "светоносен". Впервые фосфор получил гамбургский алхимик Г. Брандт в 1669 г. Смесь человеческой мочи, древесного угля и песка он сначала выпарил, а затем прокалил. Получилось вещество, которое светилось в темноте. Так была открыта первая модификация фосфора - белый фосфор. Брандт начинает показывать его за деньги. Способ получения удивительного вещества более 10 лет держался в секрете, и продавался фосфор дороже золота.
Тайна получения фосфора была разгадана Р. Бойлем, И. Кункелем и другими учеными. В 1771 г. Шееле получил фосфор из золы костей. Примерно в то же время Лавуазье доказал, что фосфор-элемент. Было обнаружено несколько его аллотропных модификаций: фиолетовый фосфор (получен русским ученым А. А. Мусиным-Пушкиным, 1797); красный фосфор [получен австрийским химиком А. Шреттером (1848) путем нагревания белого фосфора до 250°С в атмосфере оксида углерода(Н)]. Из белого же фосфора американский физик П. Бриджмен при температуре 200°С и давлении около 1200 МПа получил черный фосфор. Это самая устойчивая ферма элемента, следовательно, наименее активная - его с трудом можно поджечь спичкой. Сейчас насчитывают до 11 модификаций фосфора, среди них металлическая с кубической структурой.
Применение красного фосфора в производстве спичек общеизвестно. Входит элемент № 15 и в состав важнейших минеральных удобрений-фосфорных. Первое из них-суперфосфат-было создано англичанином Лаузом в 1839 г. при действии серной кислоты на костную золу. Фосфиды галлия и индия (GaP и InP) являются полупроводниками, фосфид меди (Са3Р) служит добавкой к бронзам, улучшая их литейные качества, повышая коррозионную стойкость. На основе фосфора созданы фосфорорганические инсектициды-тиофос, хлорофос и др. Важное значение имеет фосфор и в жизни организмов: фосфорорганические соединения способствуют обмену углеводов, а АТФ и АДФ-непременные участники энергетического обмена.
Если в том, что многие соединения фосфора необходимы для жизни, ученые убедились еще два века назад, этого долго не могли сказать о мышьяке. Обычно слова "яд" и "мышьяк" ассоциируются в одно понятие. Да и русское название происходит от слов "мышь" и "яд" - мышиный яд. Особой популярностью в средние века пользовался "белый мышьяк" - оксид мышьяка(Ш). Этот универсальный яд действовал безотказно и не оставлял улик. Недаром алхимики изображали мышьяк в виде извивающейся змеи с раскрытым ртом. С тех пор и утвердилась за элементом № 33 такая "слава".
На основе мышьяка были созданы боевые отравляющие вещества (БОВ): арсин, люизит, дифенилхлорарсин и др., а также инсектициды. При этом необходимо отметить, что сам мышьяк ... не ядовит! Он найден в живых организмах и причислен к "элементам жизни". В больших дозах соединения мышьяка-яд, в малых - стимулируют жизненные процессы. В организме человека около 10_5% мышьяка от общего веса. Элемент № 33 необходим прежде всего для синтеза гемоглобина (хотя сам и не входит в его состав), для процессов окисления и обмена: он стимулирует кроветворение. И возможно, что со временем исследователи установят и другие его функции в организме.
Как и фосфор, мышьяк имеет аллотропные модификации: серый, или металлический (получивший название за металлический блеск), желтый-довольно мягкий, напоминающий воск, и черный. Устойчив при обычных условиях только серый мышьяк. Соединения этого элемента были известны с давних времен: они упоминаются у Аристотеля, Диоскорида, Зосимы. Элементная природа мышьяка была установлена в 1789 г. Лавуазье.
Мышьяк в основном добавляют к металлам или сплавам для придания твердости, стойкости к окислению и т. д. Гораздо большее применение нашли соединения мышьяка: арсениды галлия и индия GaAs и InAs - отличные полупроводники; оксид мышьяка(Ш) используется для обесцвечивания стекол, консервирования кож и мехов; арсенаты натрия и кальция-инсектициды, а сальварсан, неосальварсан, миарсенол, арсенит калия - медицинские препараты.
VI группа. Из элементов VI группы к неметаллам относятся кислород, сера, селен и теллур. У элементов этой группы идет дальнейшее заполнение внешней электронной оболочки-на ней находится уже 6 электронов и до завершения недостает всего двух электронов. Однако по мере увеличения порядкового номера (и числа электронных оболочек) сила притяжения валентных электронов уменьшается, и уже сера может отдавать свои валентные электроны более электроотрицательному элементу (например, кислороду), проявляя степень окисления + 4 и +6. Изменяются и другие свойства: увеличивается температура плавления (от - 218,9°С у кислорода до + 449,8°С у теллура) и плотность (соответственно от 1,27 до 6,24 г/см3); кислород -газ, остальные же элементы - твердые вещества; сера не проводит электрический ток, а селен и теллур-полупроводники. Все эти элементы имеют аллотропные модификации.
В 1785 г. голландский ученый Мартин ван Марум, работая с электростатической машиной, обратил внимание на специфический освежающий запах. Он приписал его особой "электрической материи", которая обладала сильными окислительными свойствами. Аналогичные наблюдения при опытах с электростатической машиной описывают и другие экспериментаторы. Через 55 лет, в 1840 г., швейцарский химик Христиан Шёнбейн, наблюдая изменение свойств кислорода при его пропускании через электрический разряд, пришел к выводу, что образуется особый газ, который он назвал озоном (от озо-пахну). В незначительных концентрациях озон придает ту свежесть воздуху, которая ощущается после грозы.
Только 20 лет спустя английские физики П. Тета и Т. Эндрьюс установили, что озон - это "сгущенный кислород", а еще через шесть лет французский химик Я. Соре установил его формулу (О3).
Озон-газ нестойкий. В небольших концентрациях он разлагается очень медленно, но при больших (выше 48% озона по массе) разложение сопровождается взрывом. Озон-один из сильнейших окислителей. Он окисляет все металлы (кроме золота и платиновых металлов), почти моментально разрушает большинство органических веществ (в том числе и красители). Озон очень ядовит; приятная свежесть, которую мы ощущаем после грозы, обусловлена очень малой его концентрацией. Но уже при содержании озона в воздухе в соотношении 1 :1 000 000 по объему человек чувствует усталость и головную боль. В очень малых, "бодрящих" количествах озон образуется в сосновых борах: он выделяется при окислении скипидара и других веществ, содержащихся в смолах.
Озон - важная составная часть атмосферы, хотя его там крайне мало (у земной поверхности содержание озона колеблется от 10-7 до 10-6 об.%); в верхних слоях атмосферы его несколько больше. Если сконцентрировать весь озон атмосферы у поверхности земли, то его слой не превысит 3-5 мм (при нормальных условиях). Основная масса озона сосредоточена на высоте 25-30 км, тут устанавливается равновесие между процессами образования озона и его распада:
O2 = О + О; O2 + О = О3
Слой озоносферы задерживает коротковолновое ультрафиолетовое излучение, которое опасно для всего живого. С другой стороны, озоносфера отражает инфракрасное (тепловое) излучение Земли и тем самым предохраняет ее от охлаждения.
Озон, обладающий сильными окислительными, дезинфицирующими и бактерицидными свойствами, находит широкое применение: для отбеливания бумаги, тканей, масел, муки; на консервных и пивоваренных заводах; при очистке питьевой воды (озонированная вода имеет хорошие вкусовые качества); для улавливания серебра из сточных вод предприятий, вырабатывающих фотоматериалы (если через такую воду продувать озон, образуется оксид серебра, который выпадет в осадок; таким способом удается извлечь до 99% серебра, тогда как другими методами-не более 60%); этот "послужной список" постоянно расширяется.
Аллотропные модификации образует и сера (ромбическую при обычных условиях и моноклинную при нагревании выше 96°С). С ней люди познакомились очень давно. Ядовитым дымом, образующимся при ее горении, они очищали жилища от "нечистой силы" (а заодно и от насекомых). Использовали серу (точнее, ее диоксид-сернистый газ) для отбеливания тканей; сера и сейчас входит в состав некоторых целебных мазей.
В V в. н.э. в Византии была создана горючая смесь ("греческий огонь")-грозное оружие, состав которого точно неизвестен. Предполагают, что смесь состояла из нефти, смол, серы и некоторых других веществ. На смену "греческому огню" в средние века пришел порох, также содержащий серу. Особым расположением пользовалась сера у алхимиков, считавших ее (как мы уже знаем) "началом горючести", "отцом всех металлов". Только в 1770 г. А. Лавуазье доказал, что сера - индивидуальный элемент. Русское название элемента сера производят от санскритского цира, что означало светло-желтый цвет.
Сера нашла широкое применение в промышленности для производства серной кислоты, спичек, гидросульфита кальция Ca(HSO3 )2, используемого при выработке бумаги; ее добавляют в марганцовистую сталь. Она незаменима и в сельском хозяйстве-для предотвращения заболеваний виноградной лозы и хлопчатника, повышения урожайности зерновых культур, увеличения морозостойкости растений. Без серы невозможно получить резину из каучука: она необходима для вулканизации. Сера входит в состав многих лекарств-сульфамидных препаратов, антибиотиков, она содержится в незаменимых аминокислотах метионине, цистеине, во многих ферментах.
Очень важен для живых организмов и аналог серы-селен. Он обнаружен в сетчатке глаза и способствует преобразованию световой энергии в энергию электрического потенциала сетчатки глаза. Чем больше селена, тем острее зрение. У человека его около 7 мкг, а у орла - 780 мкг! Влияет селен и на многие ферментативные реакции; его недостаток ведет к тем же изменениям в организме, что и недостаток витамина Е. Однако большие дозы этого элемента чрезвычайно вредны для организма, а его соединения ядовиты. С их действием люди познакомились в начале XIX в., когда белые переселенцы искали свободные земли на северо-западе США. На границе штатов Небраска и Вайомин они нашли прекрасную долину. Но через несколько лет начались болезни, и что особенно страшно-при обильных урожаях люди умирали от ... истощения. Медицина не могла помочь. Невероятные слухи поползли про Долину духов ... Только в 20-х гг. нашего века была выяснена причина: земля в долине богата селеном, и растения берут его из почвы вместо серы. Для животных и человека эта замена оказалась неприемлемой.
Селен был открыт в 1817 г. Я. Берцелиусом в остатках медных руд при попытке выделить оттуда теллур. Новый элемент получил свое имя от греческого названия луны-селене. Этим подчеркивалось, что как Луна является спутником Земли, так и селен - спутник теллура.
Интересно, что под действием света электропроводность селена увеличивается, а энергия света непосредственно преобразуется в электрическую. Это явление нашло применение в экспонометрах и других приборах, измеряющих освещенность. Селену обязана своим возникновением ксерография (электрография), позволяющая получать до 50 000 черно-белых копий с любого оригинала без замены селенового барабана.
Теллур, открытый в 1782 г. венгерским исследователем фон Рейхенштейном, был назван так в честь нашей планеты (от латинского tellus-Земля) немецким химиком М. Клапротом. Основное его использование-полупроводниковая техника; теллур-ценная легирующая добавка к металлам и их сплавам (медь, олово, свинец, сталь), увеличивающая коррозионную стойкость. Применяется теллур и для вулканизации каучука, для придания стеклу коричневой окраски и повышения коэффициента преломления.
VII группа. Теперь перейдем к галогенам - элементам главной подгруппы VII группы. Поскольку к концу периода неметаллические свойства усиливаются, то галогены, расположенные в конце периодов (за ними только инертные газы), являются типичными неметаллами. На их внешней электронной оболочке, близкой к завершению, находится семь электронов. Недостающий до завершения оболочки один электрон галогены присоединяют в химических реакциях, проявляя степень окисления - 1. У хлора, брома и иода может происходить распаривание двух пар р-электронов и одной пары s-электронов за счет энергии, сообщаемой извне (например, от других атомов), тогда степень их окисления повышается до + 7.
Первым из галогенов был открыт хлор (К. Шееле, 1774). Полученный желто-зеленый газ с "пронзительным запахом" шведский ученый принял за сложное вещество и назвал "дефлогистированной соляной кислотой". Лавуазье и Бертолле считали, что этот газ является оксидом неизвестного элемента "мурия". В 1807 г. знаменитый английский химик Гемфри Дэви при электролизе поваренной соли получил тот же газ, что и Шееле. Три года пытался Дэви выделить из него мифический "мурий", но безуспешно. Он пришел к выводу, что получил новый элемент и назвал его хлорин (от хлорос- желто-зеленый). Позднее, через пять лет, Гей-Люссак дал этому газу название хлор, которое сохранилось до сих пор во всех странах, кроме англоязычных, где элемент № 17 продолжают называть хлорином. А за год до этого немецкий ученый Иоганн Швейгер предложил еще одно имя-галоген (от хальс-соль и геннао - рождаю), т.е. солерод, что отражало способность хлора давать соли-хлориды. Впоследствии название "галогены" распространили на всю группу элементов с аналогичными свойствами.
В 1811г. французский технолог Бернар Куртуа нашел в золе морских водорослей вещество, образующее "пар великолепного фиолетового цвета", которое соединялось с металлами, фосфором и водородом. Гей-Люссак, изучив это вещество, установил, что это новый элемент, и дал ему название иод (от иоэйдеос -темно-синий, фиалковый).
Третьим из этой группы элементов был открыт бром. Впервые его получил в 1825 г. студент Гейдельбергского университета К. Лёвиг, действуя на воду минерального источника Крейцнахе хлором. В том же году в Парижской Академии наук было сделано сообщение французским химиком Антуаном Баларом о том, что при изучении маточных рассолов он выделил темно-бурую жидкость, по всей вероятности являющуюся новым элементом. Комиссия Академии, проверив это сообщение, подтвердила открытие Балара и предложила назвать элемент бромом (от бромос - зловонный).
Поистине трагичной оказалась история открытия и изучения фтора. В 1771 г. К. Шееле, исследуя плавиковый шпат CaF2 (флюорит, от латинского fluore-течь), применяемый для снижения температуры плавления руд и шлаков, предположил, что он состоит из известковой земли, соединенной с неизвестной кислотой, получившей позднее название плавиковой. В 1816 г. А. Ампер установил точный состав этой кислоты-она является соединением водорода с новым элементом, который он назвал фтором (от фторос-разрушение, гибель). Это имя было принято только в России, а в остальных странах его называют "флюором" по названию минерала, в состав которого он входит. Ампер предложил Дэви выделить из кислоты этот элемент. Дэви долго пытался это сделать; после этих опытов он тяжело заболел, так и не добившись успеха. Еще более тяжелая участь постигла других химиков: погибают ирландец Т. Нокс, француз Д. Никлес, бельгиец П. Лайет; заболевают Д. Нокс, Ж. Гей-Люссак, Л. Тенар. И только в 1886 г. французский химик Анри Муассан, подвергнув электролизу плавиковую кислоту при - 25°С, получил свободный фтор. За эту работу Муассану в 1906 г. была присуждена Нобелевская премия.
Галогены-самые активные из неметаллов-в природе встречаются только в виде соединений. Они нашли широкое применение, об этом известно из учебников химии. Мы приведем здесь еще несколько примеров.
Ядовитые свойства хлора и некоторых его соединений использовались при создании БОВ-иприта, хлорпикрина, фосгена и др. Элемент № 17 применяется для получения неорганических солей (хлоридов цинка и алюминия, хлората калия), пестицидов (дихлорана, хлорофоса), растворителей (хлорбензола, четыреххлористого углерода), в медицине (хлороформ), в производстве полимеров (поливинилхло-рид, волокно хлорин и др.), для получения хлоропренового каучука и т.д.
Другой галоген-иод-известен нам прежде всего как антисептическое средство, он входит в состав лекарственных препаратов для лечения базедовой болезни, склерозов. Иоду обязана своим возникновением фотография. В 1839 г. французы Л. Дагерр и Ж. Ньепс провели первые фотосъемки. Они использовали полированную серебряную (или медную, но посеребренную) пластинку, предварительно обработанную парами иода, в результате чего пластинка покрывалась тонким красноватым налетом (слоем) ио-дида серебра. После фотографирования пластинку проявляли парами ртути; там, куда попадал свет, ртуть соединялась с серебром и образовывалась светлая амальгама; в темных же местах реакция не проходила. Затем пластинку промывали серноватистокислым натрием: он смывал иодид серебра и освобождал более темную поверхность металла. Снимок был готов, но... его можно было рассматривать только под углом, в противном случае пластинка блестела и ничего нельзя было разглядеть. Такие снимки получили название дагерротипов.
Иод стали использовать в производстве ламп накаливания, работающих по иодно-вольфрамовому циклу. Внутрь таких ламп вносится небольшое количество иода, который соединяется с испарившимся вольфрамом, образуя иодид WI2 o Попав на разогретую спираль, он разлагается на иод и вольфрам; последний возвращается на спираль, а иод может опять вступать в реакцию с новыми порциями испарившегося вольфрама. Словом, иод "перевозит" металл с места на место. Благодаря этому увеличивается срок службы лампы.
Фтор идет на производство фторопластов, фреонов, входит в состав некоторых лекарственных препаратов (5-фторурацил, фторэтан). Соединения NF3, OF2 и другие обладают высокими окислительными свойствами, и их используют в ракетном топливе. Гексафторид урана применяется для разделения изотопов урана. Фторид кальция-флюорит, как мы уже знаем, в больших количествах расходуется в металлургии.
Области применения брома также очень разнообразны. Его соединения используются в медицине как успокаивающие средства, антисептики, антибиотики. Применение брома в фотографии общеизвестно. Соединения брома добавляют в этилированные бензины с целью удаления из двигателя свинца, образующегося при разложении антидетонатора - тетраэтилсвинца. В органическом синтезе с помощью брома и его соединений получают целый ряд веществ (броминдиго, бромбензол и другие).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'