
Глава 3. Распад и взаимодействие электролитов
Как же протекает электролитическая диссоциация? Этот процесс складывается из следующих стадий: 1) ориентации молекул воды; 2) ионизации электролита; 3) диссоциации электролита; 4) гидратации его ионов.
Теория гидратации была разработана молодым тогда русским ученым Иваном Алексеевичем Каблуковым, впоследствии знаменитым химиком. В 1891 г. в своей докторской диссертации "Современные теории растворов (Вант-Гоффа и Аррениуса) в связи с учением о химическом равновесии" он впервые высказал предположение, что в растворе происходит гидратация ионов растворенного вещества и образуются "непрочные соединения". Это дополняло представления Аррениуса, который, будучи сторонником "физической" теории растворов, считал, что никакого взаимодействия между растворителем и веществом не происходит и что молекулы распадаются на свободные ионы.

Иван Алексеевич Каблуков (1857-1942)
Итак, в водных растворах сначала гидратированные молекулы растворенного вещества распадаются на ионы, которые в свою очередь тоже гидратируются. Гидратация несколько затрудняет образование молекул из ионов при реакциях в растворе. Каждому иону соответствует определенное число молекул гидратной воды, причем катионы гидратируются в большей степени, чем анионы; к примеру, медный купорос содержит пять молекул воды-из них четыре связаны с катионом меди и одна с анионом SO2-4 (CuSO4-5H2O); железный купорос - гептагидрат: шесть молекул воды из семи находятся у катиона железа, а одна у сульфат-аниона (FeSO4-7H2O). Протон образует ион гидроксония Н3О+.
Электролитическая диссоциация-процесс обратимый: наряду с ионизацией происходит образование недиссоциированных молекул из ионов - моляризация. В растворе устанавливается равновесие, которое характеризуется степенью диссоциации а-отношением числа молекул, распавшихся на ионы (n), к общему числу молекул, находящихся в растворе (N); обычно ос выражают в процентах:
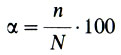
Но степень диссоциации зависит от концентрации электролита, поэтому более общей характеристикой является константа диссоциации (К), которую выводят, применяя закон действия масс:
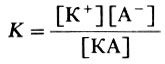
где [К+]-равновесная концентрация катионов, [А-]-равновесная концентрация анионов, а [КА]-равновесная концентрация электролита.
Многоосновные кислоты, многокислотные основания, кислые и основные соли диссоциируют ступенчато, и для каждой такой ступени будет своя константа диссоциации. Это хорошо видно на примере диссоциации ортофосфор-ной (фосфорной) кислоты при
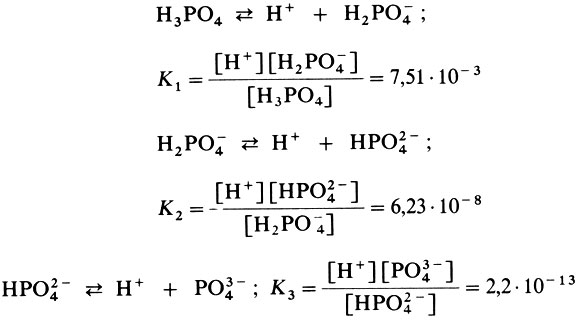
Из этих данных видно, что на первой ступени диссоциации ортофосфорная кислота ведет себя как более сильная кислота.
А что, вообще, считать кислотой?
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'