
Глава 4. Что считать кислотой?
Вопрос кажется странным. Как что? Для этого есть определения, знакомые из курса химии:
Кислоты - это сложные вещества, состоящие из атомов водорода, которые могут замещаться на атомы металла, и кислотных остатков.
Но ведь и вода содержит атомы водорода, которые могут замещаться атомами металла:
2Н2O + 2Na = 2NaOH + Н2
Значит, воду можно отнести к кислотам? Не спешите с ответом. Вот другое определение этих веществ:
кислотой является водородсодержащее соединение, водный раствор которого обладает следующими свойствами: проводит электрический ток, при реакции с металлическим цинком выделяет водород, окрашивает лакмус в красный цвет, имеет кислый вкус.
Вода под это определение не подходит... А вот еще одно-на основе теории электролитической диссоциации:
кислоты-это вещества, при диссоциации которых образуются ионы водорода.
Тщательными исследованиями было установлено, что вода-электролит, хотя и очень слабый. Она диссоциирует:
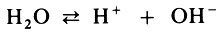
При этом образуются катионы-протоны. Значит, вода является кислотой? Но... не будем торопиться.
Итак, что же подразумевают под кислотой?
Прежде всего следует заметить, что единого подхода к определению кислот (и оснований) нет до сих пор. Наиболее распространенными являются теории датского химика Д. Бренстеда и американского физикохимика Г. Льюиса, созданные независимо друг от друга в 1923 г. В своих теориях они исходят из того, что кислотные или основные свойства вещества проявляют в определенных типах реакций; при этом два участвующих в реакции вещества рассматриваются по отношению одно к другому как кислота и как основание.
По Бренстеду, кислота-это вещество, которое отдает протон (катион водорода), т.е. является донором протона, а основание-это вещество, которое принимает протон, т.е. акцептор протона. Так как реакции сопровождаются передачей протона, они называются протолити-ческими, а теория Бренстеда - протолитической теорией кислот и оснований. Интересно, что согласно этой теории кислотой (и основанием) могут быть не только нейтральные молекулы, но и ионы.
Что же по теории Бренстеда представляет собой вода? Разберем это на отдельных примерах. Вот запись реакции между основанием и кислотой (реакция нейтрализации):
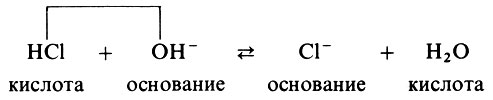
Теперь приведем реакцию диссоциации соляной кислоты :
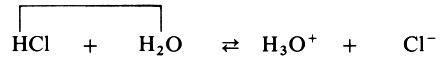
Вода здесь ведет себя как основание.
Как видите, не так просто ответить на вопрос, что такое кислота и, соответственно, к какому классу-кислотам йли основаниям - отнести воду. Все зависит от конкретных условий процесса, а реагирующие кислоты и основания являются таковыми только по отношению друг к другу. Вода, дающая одновременно катионы водорода и гидроксид-ионы, относится к амфотерным электролитам, или амфолитам.
Протолитическая теория охватывает большой круг реакций, в том числе и реакции в неводных растворах:
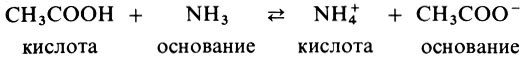
А куда же отнести те вещества, в составе которых нет водорода (апротонные)? В этом случае на помощь приходит теория Г. Льюиса, согласно которой кислотой называется вещество, присоединяющее пару электронов (акцептор электронной пары), а основанием - вещество, отдающее эту электронную пару (донор электронной пары). В результате реакции образуются новые соединения с устойчивой группировкой электронов (обычно 8) и донорно-акцепторной связью, например
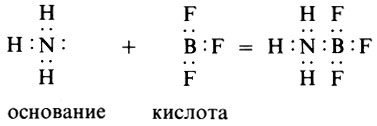
В этой реакции фторид бора-льюисова кислота. Значит, для льюисовых кислот совсем не обязательно наличие водорода, а поэтому, чтобы не путать, всегда делают оговорку, о каких кислотах (и основаниях) идет речь-о бренстедовых или льюисовых, протонных или апротонных.
Таким образом, свойства кислот и оснований Лыоио связывает только со строением внешних электронных оболочек, а не с каким-либо определенным элементом (водород). Однако обе теории имеют внутреннюю связь-ведь и протон Бренстеда, и кислота Льюиса обладают большим сродством к электронной паре.
После разработки электронных представлений о строении веществ были созданы многочисленные теории кислот и оснований. Новые принципы классификации этих веществ предложили американский ученый Р. Белл, датский ученый Н. Бьеррум, советские химики М. И. Уса-нович, А. И. Шатенштейн. Они пытались выявить то общее, что имеется в основных теориях - Бренстеда и Льюиса. Так, Белл считает необходимым оставить для соединений водорода термины "кислота" и "основание", введенные Бренстедом, апротонные соединения (акцепторы электронов) называть "кислотами Льюиса", а доноры электронов - "основаниями Льюиса".
Примерно в то же время Н. Бьеррум, изучавший свойства воды и водных растворов электролитов, предложил для более точного определения кислотно-основных свойств различных веществ ввести понятие "антиоснование". Основанием он называл соединение, присоединяющее протон (акцептор протонов) или отдающее электронную пару (донор электронных пар). Антиоснование, по Бьерруму, обладало способностью присоединять основания или электронные пары. Кислоту же он считал донором протонов или акцептором (поглотителем) электронных пар.
Советский ученый А. И. Шатенштейн в конце 50-х г. предложил более общую формулировку:
кислота - электроноакцепторный реагент, водород которого взаимодействует с основанием; основание-электронодонорный реагент, проявляющий сродство к протону.
Кислоты - вещества весьма разнообразные, и известны яи с глубокой древности. Раньше их часто называли "КИСЛЫМИ спиртами".
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'