
Глава 5. "Кислые спирты"
Первыми неорганическими кислотами, полученными алхимиками, были серная, азотная и соляная.
В XIII в. Альберт Великий описал способ получения серной кислоты из железного купороса, который нагревали в чугунных котлах, а образовавшиеся пары серного ангидрида SO3 направляли в холодильник, где и получалась серная кислота:
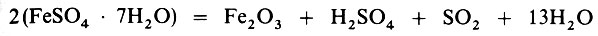
По исходному сырью серную кислоту называли "купоросным спиртом" или "купоросным маслом".
Позже, в XV в., серную кислоту стали получать в стеклянных колбах, нагревая смесь серы и селитры. Это послужило прообразом получения серной кислоты нитрозным способом. Интересно, что на первом заводе, построенном в 1740 г. в Англии, сжигание серы в селитре осуществлялось в специальных ковшах, подвешенных в огромных стеклянных баллонах.
Как только было замечено, что свинец устойчив к действию серной кислоты, этим не замедлили воспользоваться. Вместо стеклянных сосудов стали применять свинцовые короба, а затем и камеры. Образовавшийся серный ангидрид поглощался водой также в камерах. Первый завод с такими камерами был построен в Шотландии в 1746 г.
В начале XIX в. французский фабрикант Ш. Дезорм и химик Н. Клеман усовершенствовали процесс, предложив непрерывно подавать в камеры оксид серы (IV) из обжиговой печи в смеси с избытком воздуха, небольшим количеством азотной кислоты и водяного пара. При разложении азотной кислоты образуется оксид азота (IV), он окисляет SO2 до SO3, который затем поглощается водой.
Но для камерного способа требовалась дорогая азотная кислота, поэтому Гей-Люссак предложил улавливать оксиды азота серной кислотой в специальных башнях, размещенных позади камер. В 1842 г. он разработал этот технологический процесс. Башня, в которой улавливались оксиды азота, стала называться именем ученого, а серная кислота с растворенными оксидами азота - "нитрозной". Так возник башенный, или нитрозный, способ производства серной кислоты.
В 1859 г. английский химик-технолог Д. Гловер открыл способ извлечения оксидов азота из нитрозной кислоты горячими газами, образующимися при обжиге серных руд. Процесс извлечения осуществлялся в специальных башнях (башнях Гловера), установленных перед камерами. Теперь оксиды азота совершали круговорот.
Однако производительность камерных установок была низкой; в начале XX в. был разработан контактный способ, основанный на применении катализаторов. В 1831 г. английский ученый П. Филлипс получил патент на производство серной кислоты таким способом: SO2 окислялся кислородом воздуха до SO3 в присутствии платины.
Развитию этого метода во многом способствовали работы немецких химиков Р. Книтча и К. Винклера, которые в конце XIX-начале XX в. изучали влияние различных факторов-температуры, концентрации оксида серы (IV), действия каталитических ядов и т. д.-на выход серной кислоты. Последнее крупное усовершенствование-замена платинового катализатора на ванадиевый (1901 г., Де-Хэн; работы советских ученых А. Е. Ададурова, Г. К. Борескова, М. Г. Слинько). С тех пор контактный способ производства серной кислоты не претерпел существенных изменений, он подробно описан во всех школьных учебниках.
История азотной кислоты начинается примерно тогда же, что и серной. Правда, неизвестно, кто получил ее впервые, но первое описание встречается в сочинении алхимика Бонавентуры (127O), который установил, что азотная кислота ("крепкая водка") растворяет серебро, так что его можно отделить от золота. В сочинениях алхимиков XIV в. есть рецепты получения азотной кислоты (например, подвергнуть перегонке смесь медного купороса, селитры и квасцов). Если смешать образовавшуюся азотную кислоту с нашатырем (хлоридом аммония), то в такой смеси растворится даже золото-"царь металлов", поскольку получается "царская водка" (смесь азотной и соляной кислот).
В 1650 г. И. Глаубер заменил купорос серной кислотой:
2NaNO3 + H2SO4 = Na2SO4 + 2HNO3
На протяжении почти двух веков азотную кислоту именно так и получали. Но потребность в "крепкой водке" росла, а природные запасы селитры быстро истощались, да и сама селитра оказалась прекрасным удобрением. Где же выход? Можно было бы получать азотную кислоту по схеме
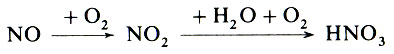
Но для этого нужен дешевый оксид азота (II). Получать его непосредственным окислением азота воздуха экономически невыгодно - требуется огромное количество электроэнергии. Вот тогда-то и вспомнили: еще в 1839 г. немецкий ученый Ф. Кюльман обнаружил, что аммиак в присутствии платины окисляется до азотной кислоты:
NH3 + 2O2 = HNO3 + Н2O
В конце XIX и начале XX в. исследования в этом направлении продолжались, и в 1909 г. в Германии был построен первый опытный завод (на котором действовал предложенный В. Оствальдом аппарат для каталитического окисления аммиака), выпускавший в год около 1800 т азотной кислоты.
В России азотную кислоту получали исключительно из привозной чилийской селитры. Во время первой мировой войны ввоз ее прекратился, так как немецкий флот блокировал морские пути. Ощущался явный недостаток этого ценнейшего сырья. Химический комитет при Главном артиллерийском управлении приступил к разработке способа получения азотной кислоты из аммиака. В 1915 г. инженер И. И. Андреев создает проект опытного завода в Макеевке (Донбасс), а в марте следующего года в г. Юзовке стали строить крупный завод, который в феврале 1917 г. дал первую продукцию.
Основным сырьем служили аммиачные воды коксохимических заводов. Из этих вод выделяли аммиак, смешивали с воздухом и направляли в контактный аппарат с катализатором (сплав платины с родием). Такой катализатор изготовлялся по способу Андреева в виде сетки, что увеличивало производительность аппаратов и упрощало их конструкцию. За сутки завод давал 17 т 33%-ной азотной кислоты.
Сейчас основную массу ее получают методом окисления аммиака, с которым читатели знакомы из учебника химии. С развитием науки и техники наметились и другие пути получения азотной кислоты. Одним из перспективных является так называемый плазменный способ. В плазмотрон подается нагретый до 5000 °С воздух, а точнее, плазма-смесь атомов, ионов и радикалов, на которые распадаются молекулы газов воздуха при такой температуре. В результате взаимодействия кислорода и азота образуется оксид азота (II).
Значительно позднее узнали соляную кислоту. Первое описание ее получения встречается в сочинении алхимика Василия Валентина (XVI в.) "Триумфальная колесница антимония": смесь поваренной соли, железного купороса и квасцов подвергалась прокаливанию, образовывалось новое вещество, названное "кислым спиртом". Оно разъедало металлы и ткани, вызывало кашель и удушье. Тот же "кислый спирт" был получен и другим алхимиком, Андреем Либавием, в 1595 г.
Через полвека изучением этого вещества занялся Глаубер. Действуя на поваренную соль концентрированной серной кислотой, он выделил газ (хлороводород), который растворил в воде. Полученную таким образом кислоту Глаубер назвал "духом соли" или "соляным спиртом". Познакомившись с ее свойствами, он рекомендовал ее для растворения минералов, но главным образом как заменитель уксусной кислоты и лимонного сока в кулинарии (при консервировании фруктов, отворажива-нии молока, приготовлении пищи и т.д.). Получал Глаубер и концентрированную ("дымящую") соляную кислоту. Она вплоть до XVIII в. во многих странах именовалась "глауберовым соляным спиртом".
Очень долгое время соляная кислота не находила применения. Образующийся во многих производствах хлороводород выпускали в атмосферу, и он оседал на землю в виде тумана, губительного для всего живого. Не помогали даже очень высокие трубы: газ все равно опускался вниз. Тогда стали поглощать хлороводород водой, переводя его в соляную кислоту. Но где же использовать ее? Приходилось сливать кислоту в реки, отчего вода в них становилась непригодной для обитателей водоемов и для питья.
В 60-х годах XIX в. англичанин Г. Дикон предложил получать хлор из хлороводорода путем его окисления. Примерно тогда же начинают заменять серную кислоту соляной при травлении металлов. Так постепенно соляную кислоту стали использовать в промышленности.
А как же ее получают сейчас? В некоторых странах ее вырабатывают из поваренной соли, действуя на нее серной кислотой (образующийся при этом сульфат натрия находит свое применение). В начале нашего века быстро распространился другой способ - прямой синтез из водорода и хлора, более экономичный и не требующий серной кислоты. С 1936 г. этим методом впервые стали получать соляную кислоту в СССР, а сейчас он является основным.
Синтез хлороводорода осуществляется в специальных печах, в которых имеются горелки, состоящие из двух кварцевых трубок, вставленных одна в другую: по внутренней подается хлор, а по наружной - водород. Последнего поступает на 3-5% больше, чем хлора, чтобы получающийся хлороводород и соляная кислота не загрязнялись хлором: водород по сравнению с ним практически не растворяется в воде и его легко отделить. Выходящий из печи хлороводород направляется в поглотительные башни с насадкой, в которые он подается снизу, а вода сверху. Таким образом получается 31-33%-ная соляная кислота.
После второй мировой войны с развитием промышленного органического синтеза возросло производство хлорорганических веществ, а при этом в качестве побочного продукта получается хлороводород в смеси с другими продуктами. Поэтому утилизация отходов органического синтеза-тоже важный источник получения соляной кислоты.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'