
Для тех, кто хочет знать подробнее
Образование новой фазы. Физическая химия называет фазой однородный по составу объем какого-нибудь газа, жидкости или твердого тела. Обычно мы имеем дело с соседством двух, трех или более фаз, границами между которыми служат поверхности их раздела. Так, стакан воды включает три фазы: вода, воздух, стекло - и три фазовые поверхности раздела: вода - воздух, вода - стекло, стекло - воздух.
При понижении температуры воздуха водяные пары становятся пересыщенными и, конденсируясь, образуют капли. Внутри перегретой выше точки кипения жидкости появляются пузырьки пара. При охлаждении воды кристаллизуется лед. При испарении и концентрировании водного раствора соли выпадают ее кристаллы... Все это примеры образования новой фазы, и одним из частных случаев такого процесса является получение кристаллов алмаза.
Вода в условиях нормального атмосферного давления кипит. и замерзает при определенных температурах. Точные значения температур этих двух фазовых переходов воды использованы в качестве базы для конструирования температурной шкалы Цельсия. Одна базовая точка - температура образования льда - 0°, другая - температура кипения воды - 100°. Однако, если воду тщательно очистить от пылинок и поместить в виде взвешенной капли в другую жидкость близкого удельного веса, с которой она не смешивается, то вода замерзнет при значительно более низкой температуре. Рекордное переохлаждение воды достигает -40°. В то же время вода, налитая в очень чистую свежевыдутую стеклянную ампулу, вскипает при температуре выше 100° на несколько десятков градусов.
Занимательный парадокс: чем тщательнее ставить такие опыты и очищать от примесей вещества, тем больше ошибка, получающаяся при составлении термометрической шкалы. Причина парадокса вскрылась после внимательного рассмотрения самых начальных стадий зарождения новой фазы.
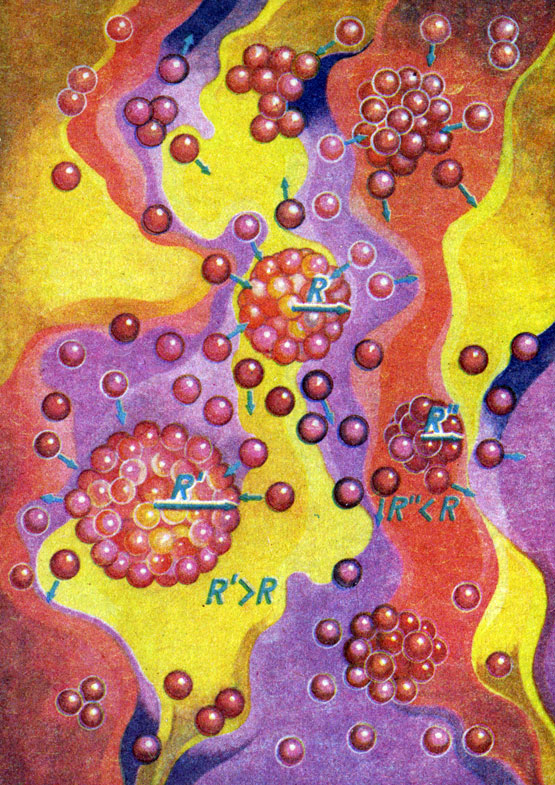
Нуклеация при конденсации паров. Пар, находящийся в термодинамическом равновесии с жидкостью, считается насыщенным. В системе насыщенного пара и жидкости поверхность раздела фаз в единицу времени пересекает в обе стороны равное число молекул: сколько их вырывается из жидкости и переходит в пар, столько же возвращается в жидкость из пара. Капелька жидкости в паре находится в равновесии, если давление окружающего пара превышает давление пара насыщенного. Иначе говоря, пар становится пересыщенным. Величина превышения давления зависит от плотности пара, радиуса капли, ее поверхностного натяжения и плотности. Впервые формулу этой зависимости получил английский физик Вильям Кельвин.
Из формулы видно, что чем меньше радиус капли, тем больше для ее равновесия должно быть превышение давления пара. Или наоборот: чем меньше пересыщен пар, тем больше должен быть радиус капли, находящейся с ним в равновесии. При определенном значении давления пересыщенного пара капли, радиус которых меньше требуемого, стремятся испаряться и, следовательно, еще больше уменьшаются в размерах. Капли большего размера, наоборот, стремятся расти дальше. Капля же размером, соответствующим давлению окружающего ее пересыщенного пара, находится в неустойчивом с ним равновесии и имеет равные возможности расти дальше или начать испаряться. Такая капля называется критическим зародышем, а процесс ее образования - нуклеацией.
Шансы, учитывающие случайный характер процессов присоединения новых молекул пара к молекулярному агрегату и их вылет из него, тем меньше, чем больше прирост энергии, затрачиваемой для получения критического зародыша. Этот прирост равен разности поверхностной энергии капли и энергии, которая выделяется за счет перехода пара в жидкость.
Сначала с увеличением размера капли затрата энергии растет, потому что перевешивает влияние поверхностной энергии, пропорциональной квадрату радиуса капли. При значении радиуса, равном радиусу критического зародыша, затраты энергии достигают максимума. Затем они уменьшаются, поскольку берет верх энергия перехода пара в жидкость, пропорциональная объему капли, т. е. кубу радиуса. В процессе нуклеации критический зародыш находится в таком же неустойчивом равновесии, как шар на шаре.
Американский физик-теоретик Дж. Гиббс показал, что необходимый прирост энергии (работа образования критического зародыша) равен одной трети поверхностной энергии капли, т. е. пропорционален квадрату радиуса капли. Но, как отмечалось раньше, чем меньше пересыщен пар, тем больше должен быть радиус критического зародыша и, следовательно, больше работа его образования.
Допустим, что из пара все же образовалась капелька, которая достигла и превзошла размер критического зародыша. Но для этого на ней должна была сконцентрироваться избыточная энергия. Это возможно только за счет случайных колебаний - флуктуации, происходящих в результате беспорядочного теплового движения молекул. Чем больше необходимый прирост энергии, тем реже будет осуществляться ее аккумуляция в капле за счет флуктуации. Поэтому число образующихся в среднем за единицу времени критических зародышей - скорость нуклеации - будет падать с уменьшением пересыщения. Точные расчеты показали, что скорость нуклеации очень резко зависит от пересыщения пара, определяющего при известном значении поверхностного натяжения радиус и поверхность зародыша и, следовательно, работу его образования.
Нуклеация при вскипании жидкости и при кристаллизации. Аналогичная, но более сложная зависимость была выведена и для случая образования в жидкости пузырьков, наполненных ее паром, т. е. для процесса вскипания. Скорость нуклеации при вскипании жидкости, подобно ее скорости при конденсации паров, значительно зависит от поверхностного натяжения жидкости и площади поверхности пузырька. Различие заключается в том, что поверхностное натяжение связано с давлением пара в пузырьке и с давлением в жидкости соотношением, вытекающим из закона Лапласа. Оно выражает разность давлений в пузырьке и в жидкости через радиус кривизны сферической поверхности пузырька и поверхностное натяжение жидкости.
Образование зародышевой капли (под микроскопом) из паров какого-либо вещества
В случае образования кристалла, например, из раствора скорость нуклеации зависит от средней поверхностной энергии граней кристалла на границе с раствором. При этом площадь поверхности критического зародыша обратно пропорциональна квадрату степени пересыщения раствора. Для синтеза алмаза при высоких давлениях пересыщают расплавленный металл атомами углерода, растворяя в нем графит. При достаточно высоких давлениях (порядка 60 килобар) графит становится менее устойчив, чем алмаз, и его растворимость в металлах (т. е. концентрация насыщения) превышает растворимость алмаза. Поэтому одновременно графит может растворяться, а алмаз расти.
Нуклеация на твердой подложке. На первый взгляд всему сказанному противоречат самые простые наблюдения: конденсация водяных паров с образованием тумана при очень небольшом пересыщении или вскипание воды при температуре, очень мало превышающей 100°. Однако эти факты объясняются тем, что в первом случае капельки тумана зарождаются на частичках пыли или солей, всегда присутствующих в атмосфере; во втором - пузырьки образуются либо на взвешенных частичках, либо на стенках сосуда, в котором кипятится вода. Здесь теория нуклеации - образования жизнеспособных зародышей новой фазы - должна быть видоизменена: присутствие подложки снижает энергию, необходимую для образования критического зародыша. Именно этим и пользуются, вызывая искусственный дождь рассеиванием частиц соли над облаками.
Теперь становится понятно, почему в очищенных веществах затруднено появление новой фазы и смещены температуры фазовых переходов. Наконец, объясняется и парадокс ошибок при тщательной постановке опыта нанесения термометрической шкалы.

Капля жидкости на твердой подложке
Рассмотрим образование зародыша жидкости на смачиваемой ею подложке. При образовании зародышевой линзочки (рис. на с. 46) появляются новые поверхности раздела: на границе жидкость - пар (с площадью S12 и поверхностной энергией σ12) и на границе жидкость - подложка (с площадью S13 и поверхностной энергией σ13). На их образование будет затрачена энергия, равная
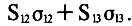
Одновременно исчезнет поверхность раздела пар - подложка на той же площади S13 , но с поверхностной энергией σ23. За счет этого будет выделена энергия S13σ23. В итоге энергия (работа), необходимая для образования зародыша жидкости на подложке, будет равна:
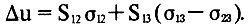
Пусть краевой угол, образуемый каплей на подложке, равен 0 (см. рис.), тогда из условия равновесия сил поверхностного натяжения (изображенных стрелками) следует:
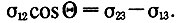
И вместо уравнения (2) мы получим:
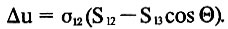
Если угол Θ мал, а, следовательно, COS Θ близок к 1 и S13 ненамного меньше S12, то энергия Дддu делается весьма малой. Отсюда понятно резкое облегчение конденсации за счет уменьшения работы образования зародыша жидкости на смачиваемой подложке по сравнению с конденсацией в объеме чистого воздуха. Облегчение тем значительнее, чем больше падает поверхностная энергия при замене контакта пара с подложкой контактом капли с подложкой.
Все это верно и для образования на подложке зародыша твердой фазы - кристаллика. Различие лишь в том, что вместо сферического купола кристалл ограничен плоскими гранями. Однако очень часто, особенно при быстром процессе, на ранней стадии роста, а тем более на стадии образования критического зародыша "огранка" не успевает образоваться, и форма зародышевого кристалла может быть близка к форме капли.
Независимо от точной формы зародыша сохраняется основной вывод об облегчении образования критического зародыша в случае, если поверхностная энергия подложки резко падает при образовании на ней зародыша. Особенно высокой поверхностной энергией обладают некоторые металлы. Именно на них при разложении углеродсодержащих газов было обнаружено образование кристалликов алмаза в условиях, когда более стабильными должны, казалось бы, быть кристаллики графита.
Механизм роста кристаллов и эпитаксия. Наибольшее падение значения энергии образования кристалла и поверхностной энергии (до нуля) получается, когда зародыш кристалла образуется на грани кристалла того же рода. Впрочем, в этом случае зародыш новой фазы не возникает, а происходит наращивание уже имеющегося кристалла. О таком процессе будет рассказано, когда речь пойдет о наращивании алмазов из газа. Сейчас важно понять, что наращивание может происходить и при низких давлениях, когда алмаз является термодинамически неустойчивой формой углерода.
Для пояснения возможности этого на первый взгляд парадоксального процесса будем рассуждать так. На поверхности кристалла алмаза выделяются атомы углерода. Но под влиянием действия атомов подложки, расположенных в определенном порядке, новые атомы строятся так, будто бы продолжают ту "кирпичную кладку", которая уже имелась. Способность кристаллических граней облегчать возникновение на их поверхности кристалликов близкой структуры называется эпитаксией. Когда речь идет о росте кристалликов того же вещества (например, алмаза), говорят об автоэпитаксии. Может случиться и так, что скорость поступления новых "кирпичиков" к строительной площадке слишком велика и в спешке они начинают укладываться или в беспорядке, образуя аморфный углерод, или же устанавливается более простой, чем в алмазе, порядок, отвечающий построению кристалликов графита.

Эпитаксия. Новые атомы строятся так, будто бы продолжают кирпичную кладку', которая уже имелась.
Непрерывные наблюдения над зародышевыми кристаллами на грани сходной по кристаллической структуре подложки выявили их подвижность. Зародыши в начальной стадии своего формирования совершают броуновское движение, танцуя на исходной кристаллической грани параллельно поверхности подложки. Только позже, постарев и сделавшись грузнее, они переходят к оседлому существованию и, очевидно, более или менее прочно срастаются с подложкой. Сходство или даже тождественность структур подложки и строящегося кристалла в ряде случаев не всегда приводит к непрерывному продолжению кирпичной кладки. Значит, явлению эпитаксии не всегда следует приписывать роль непосредственной причины облегчения кристаллизации на грани кристалла подобной же структуры. Но тогда это облегчение можно объяснить тем, что сходство или тождественность структур приводит к весьма малому значению поверхностной энергии на границе подложки и зародыша новой фазы.
Переохлаждение жидкости и стекловидное состояние. Очень наглядно явление автоэпитаксии показывает простой, но интересный опыт, который каждый может проделать сам. В серный расплав опустите на одной ниточке кристаллик моноклинной серы, а на другой - кристаллик серы ромбической. Очень скоро вы убедитесь, что, несмотря на одинаковые условия, оба кристаллика различной кристаллической формы будут расти одновременно, хотя, возможно, с различной скоростью. Если же в расплаве серы затравки не будет, то он может охладиться ниже точки нормальной кристаллизации. Точка нормальной кристаллизации - это такая температура, когда жидкая и кристаллическая сера находятся в равновесии.
Еще легче обнаружить возможность переохлаждения жидкости, если взять применяющийся в фотографии в качестве фиксатора гипосульфит и, расплавив его примерно при температуре 70°, охладить до комнатной температуры. В таком состоянии он может сохраняться долго.
Обычно кристаллизации переохлажденных жидкостей препятствует их высокая вязкость. Она свойственна охлажденным жидкостям с молекулами либо сложного состава (силикатные стекла), либо легко образующими сложные агрегаты (молекулы кварца). Г. Тамман, немецкий физико-химик, показал, что при превышении вязкостью предела порядка 1014 пуазов кристаллизация часто делается практически невозможной: изменение конфигурации молекул затруднено из-за их малой подвижности. (Пуаз - единица динамической вязкости; равна вязкости жидкости, оказывающей сопротивление силой в 1 дину взаимному перемещению двух слоев жидкости площадью 1 см2, находящихся на расстоянии 1 см друг от друга и взаимно перемещающихся с относительной скоростью 1 см/с.)
На этом основано свойство стекла долго, иногда веками, сохранять прозрачность. Но изредка она все же нарушается: в стекле образуются мелкие кристаллики, так называемый рух стекла. В некоторых случаях удается получить в "стекловидном" состоянии и вещества с очень простыми молекулами. Так, известен стекловидный углерод, возникающий в определенных условиях.
Любопытно приключение глицерина. Долгое время никому не удавалось получить его в форме кристаллов. Но вот во Франции один торговец обнаружил, что закупил у оптового торговца глицерин в виде кристалликов. Он решил, что это либо не глицерин, либо весьма загрязненный его образец. В дальнейшем после нагревания и расплавления глицериновых кристаллов и точного сравнения с "нормальным" глицерином выяснилось их тождество. Редкое явление кристаллизации глицерина было таким образом "открыто". А причиной кристаллизации стала тряска, которой подвергся глицерин во время перевозки по штормовому морю.
Итак, мы разобрали, - разумеется, в очень упрощенном виде - теорию образования новой фазы и наращивания уже имеющегося кристалла. Но как эти процессы осуществляются практически, в лабораториях?
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'