
Глава I. Общие свойства и общие закономерности
Первые в периодах
Сравним атомы элементов I группы друг с другом. Все они находятся в периодической системе Д. И. Менделеева в начале рядов, а атомы водорода, лития, натрия, калия, рубидия, цезия и франция помещаются в начале периодов. С них и начнем.
У атома водорода имеется один-единственный электрон. Первый период самый короткий - в нем всего два элемента: водород и гелий. Следующий за гелием металл - литий - составляет уже начало второго периода. У лития три электрона - два образуют прочное сочетание (первый электронный слой), а третий находится на большем расстоянии от ядра и слабее с ним связан. За литием следует семь элементов, после которых появляется металл натрий и начинается третий период. У натрия уже три электронных слоя, во втором (от ядра) слое содержится восемь электронов, в третьем - один. Этот внешний электрон, конечно, еще слабее связан с ядром, чем электрон лития: ведь в слоях, отделяющих его от ядра, десять электронов - десять отрицательных зарядов, отталкивающих внешний электрон. Вероятно, он должен легче отрываться от атома, чем это происходило у лития. Опыт показывает, что в действительности так и есть: атом натрия расстается с внешним электроном легче, чем атомы водорода и лития.
Еще через семь элементов встречается металл калий. Его атом на внешнем слое также имеет один электрон, который отделен от ядра шестнадцатью электронами, размещенными в трех предшествующих слоях (2; 8; 8; 1). Прочность связи внешнего электрона с ядром в группе этих элементов продолжает уменьшаться. Калий находится в начале четвертого - большого периода, состоящего из восемнадцати элементов.
В начале пятого периода мы видим элемент рубидии, атом которого в еще большей степени "перегружен" электронами - внешний электрон отделен от ядра тридцатью шестью электронами (2; 8; 18; 8; 1). В пятом периоде содержится также 18 элементов, и поэтому у цезия, начинающего шестой период, в атоме 55 электронов (2; 8; 18; 18; 8; 1). Шестой период (самый большой из известных) заключает в себе 32 элемента, и, когда он заканчивается, то следующий за его последним элементом- радоном элемент франций содержит 87 электронов в атоме, размещенных в семи слоях (2; 8; 18; 32; 18; 8; 1).
Понятно, что цезий легче, чем рубидий, а франций легче, чем цезий, теряют внешние электроны и, следовательно, все более активно вступают в такие химические реакции, которые связаны с отдачей электронов. Это реакции окисления. Поэтому сразу можем сказать, что общая черта всех названных элементов - наличие одного внешнего электрона - обусловливает способность окисляться, и тем легче, чем больше порядковый номер элемента. Следовательно, все элементы, стоящие в начале периодов, должны проявлять сходство друг с другом, так как все они имеют по одному внешнему электрону, и должны отличаться друг от друга, так как все они различаются числом электронных слоев, радиусом атома и энергией связи внешнего электрона с ядром.
Общая химическая активность возрастает от лития к францию в таком порядке:
Li<Na<K<Rb<Cs<Fr
Радиусы атомов и положительных ионов, выраженные в нанометрах, представлены в табл. 1, а их размеры сопоставлены на рис. 1.
| Элемент | Радиус атома | Радиус иона |
|---|---|---|
| Водород | 0,058 | |
| Литий | 0,155 | 0,078 |
| Натрий | 0,189 | 0,095 |
| Калий | 0,236 | 0,133 |
| Рубидий | 0,248 | 0,149 |
| Цезерий | 0,268 | 0,165 |
| Франций | 0,27 | - |
Обратите внимание на возрастание радиуса атома от водорода к цезию и на резкое сокращение его при переходе от атома к иону - радиус иона почти в два раза меньше, чем атома. Это указывает на значительное удаление внешнего электрона от ядра по сравнению с электронами других оболочек.
Для того чтобы оторвать внешний электрон от атома, надо совершить работу - наименьшую для атома франция и наибольшую для водорода. Так как по отношению к францию мы не располагаем точными данными, то ограничимся сравнением значений энергии отрыва электрона (энергии ионизации) от атомов водорода и щелочных металлов. Соответствующие данные приведены в табл. 2. Энергии ионизации убывают по мере роста радиуса атома. Особенно велика энергия ионизации атома водорода. На основании ее значения можно предвидеть, что водород будет сильно отличаться по свойствам от щелочных металлов. Этого, конечно, и следовало ожидать - отсутствие внутренних электронов и малый радиус атома благоприятствуют повышению энергии связи электрона и ядра.
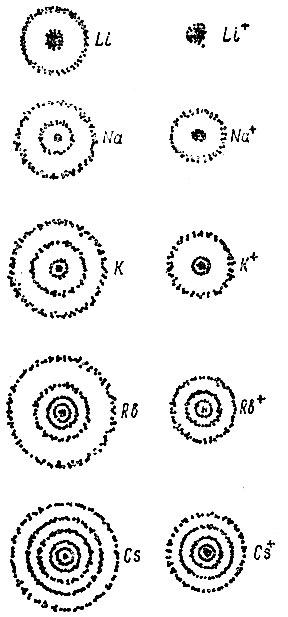
Рис. 1. Относительные радиусы атомов и ионов, а также радиусы распределений электронов на энергетических уровнях для элементов главной под группы I группы
Теперь отметим характерные химические свойства металлических элементов, начинающих периоды. Водород рассмотрим отдельно. Надо помнить, что речь будет идти об элементах, а не о простых веществах, свойства которых рассмотрим позже. Пока нас интересует поведение атомов (ионов) щелочных металлов в соединениях.
| Элемент | Энергия ионизации, эВ |
|---|---|
| Водород | 13,54 |
| Литий | 5,37 |
| Натрий | 5,12 |
| Калтй | 4,32 |
| Рубиний | 4,19 |
| Цезий | 3,86 |
| Франций | 3,8 |
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'