
Характерные соединения элементов I группы главной подгруппы
Гидриды. Все элементы этой подгруппы соединяются с водородом. При этом получаются гидриды - твердые кристаллические вещества. В гидридах атом щелочного металла заряжен положительно, а атом водорода - отрицательно (гидридный ион);
Ме+Н- (Me = Li, Na, К, Rb, Cs)
Гидриды - сильнейшие восстановители. С водой они реагируют, выделяя водород, например:
NaH + H2О = NaOH + H2
Галиды. Соединения щелочных металлов с галогенами (галиды) являются типичными солями (галогеноводородных кислот): LiCl, NaBr, KC1, KI, RbCl и т.д. Все они образуют кристаллы, в узлах которых находятся ионы металлов (катионы) и ионы галогенов (анионы). Хлорид лития образует кристаллогидрат LiCl⋅2H2О. Другие галиды кристаллогидратов не образуют.
Оксиды. Все щелочные металлы энергично соединяются с кислородом. При сгорании в кислороде литий дает оксид, а натрий пероксид Na2О2. Оксид натрия получается из пероксида при нагревании. Оксиды с водой образуют щелочные растворы гидроксидов:
Na2О + H2О = 2NaOH,
а пероксиды выделяют кислород:
2Na2О2 + 2H2О = 4NaOH + О2↑
При горении калия, рубидия и цезия образуются высшие пероксиды, например, 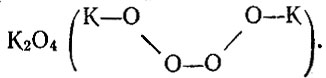 Нитриды. Щелочные металлы довольно легко соединяются с азотом. Литий взаимодействует с этим газом уже при комнатной температуре, для остальных металлов требуется нагревание. Нитриды взаимодействуют с ведой, выделяя аммиак:
Нитриды. Щелочные металлы довольно легко соединяются с азотом. Литий взаимодействует с этим газом уже при комнатной температуре, для остальных металлов требуется нагревание. Нитриды взаимодействуют с ведой, выделяя аммиак:
Li3N + 3H2O = NH3 + 3LiОН
Соли. У всех щелочных металлов соли довольно хорошо растворяются в воде, диссоциируя при этом на ион щелочного металла и анион соответствующей кислоты. Соли слабых кислот (угольной, борной, уксусной) при растворении гидролизуются, и растворы приобретают щелочную реакцию, например:
Na2SО3 + H2О-NaHSО3 + NaOH
CH8COONa + H2O = CH3COOH + NaOH
Na2CО3 + H2О-NaHCО3 + NaOH
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'