
Элементы, начинающие ряды
В I группе находятся медь, серебро и золото. Они образуют побочную подгруппу и сильно отличаются от щелочных металлов, как по химическим, так и по физическим свойствам. В этом нет ничего удивительного: перечисленные металлы помещаются в средней части больших периодов. Медь находится во второй половине четвертого периода, в начале пятого ряда. Серебро - в середине пятого периода, в начале седьмого ряда. Золото - в середине шестого периода, начинает собой девятый ряд. Элементы, расположенные в средней части ряда, вообще не проявляют резко выраженных свойств металлов или неметаллов, а названные три металла относятся к так называемым переходным элементам.
Переходными называют элементы больших периодов, в атомах которых заполняются внутренние оболочки при неизменном состоянии внешней. В четвертом периоде после элемента калия, который имеет один электрон во внешней оболочке атома, следует кальций, у которого таких электронов два. Затем идет скандий; в атоме скандия на внешней оболочке два электрона, как и у кальция, но зато на внутренней - третьей по счету от ядра и второй снаружи - появляется один электрон. Ведь в Третьей оболочке может быть всего 18 электронов, а у калия и кальция их всего лишь восемь; начиная со скандия третья оболочка "достраивается", в нее добавляется еще десять электронов. Постепенное заполнение этой оболочки происходит на протяжении четвертого ряда четвертого периода, и у меди в третьей оболочке оказывается десять добавленных электронов, а всего 18. На внешней оболочке у меди один электрон*. Форма электронных "облаков" этих добавленных десяти электронов своеобразна - она напоминает розетку (рис. 2). Облака такой формы сравнительно слабо защищают (экранируют) внешние электроны от притяжения к ядру - другими словами, ядро сильно воздействует на внешние электроны этих элементов.
* (Почему один, а не два, как у скандия? Дело в том, что 18-электронная оболочка очень устойчива, и когда она формируется в атоме, то даже внешний электрон втягивается в нее. У серебра и золота по аналогичной причине на внешней оболочке также по одному электрону.)
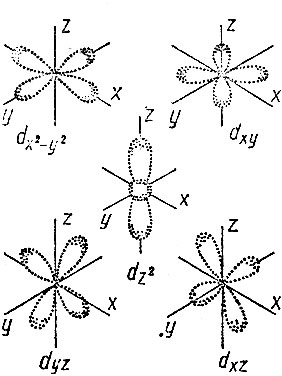
Рис. 2. Пространственное распределение электронов на d-opбиталях
В результате повышенной энергии связи внешних электронов с ядром медь проявляет значительно меньшую химическую активность, чем щелочные металлы, и с трудом расстается с внешним электроном. Только степень окисления +1 оправдывает помещение меди в I группу. Потенциал ионизации у меди больше, чем у щелочных металлов, он равняется 7,72 эВ - медь с трудом переходит в ионное состояние. Но второй потенциал ионизации у меди (20 эВ) ниже, чем у щелочных металлов. Поэтому, в то время как щелочные металлы никогда не бывают двухвалентными, т. е. не проявляют степень окисления +2, для меди, наоборот, эта степень окисления обычна. Уж если медь окислилась до степени окисления +1, то дальнейшее окисление до +2 происходит легко. Опыт показывает, что металлическая медь медленно окисляется на воздухе (медленнее, чем железо), но соеди нения меди (I) быстро окисляются в соединения меди (II).
Очень интересная реакция происходит при смешения раствора соли меди (II) с порошком металлической меди. Двухзарядные ионы меди захватывают электроны металла и превращаются в ионы однозарядные, а атом металла переходит в раствор в форме однозарядных ионов:
Cu + CuCl2 = 2CuCl
Голубой раствор хлорида меди (II) при этом становится почти бесцветным, и образуется белый осадок плохо растворимого хлорида меди (I). Медь склонна к образованию ковалентных связей, т. е. связей, осуществляемых парой общих электронов. По-видимому, соединение меди с водородом - гидрид меди - содержит такие связи: это непрочное вещество красно-коричневого цвета можно получить, действуя на раствор сульфата меди смешанным гидридом лития и алюминия: LiAlH4.
Серебро образует соединения, в которых его степень окисления равна единице. В особых условиях удается получить соединения со степенью окисления серебра равной двум, но эти соединения очень неустойчивы и проявляют свойства сильных окислителей. Они энергично присоединяют электрон, и ион серебра (II) переходит в ион (I). Серебро имеет в общем более основной характер, чем медь. Гидроксид AgOH настолько непрочен, что в свободном виде его получить не удается, но даже ничтожные количества гидроксида, образующиеся при взаимодействии оксида с водой, придают щелочную реакцию раствору. Основной характер серебра обусловлен большим числом внутренних электронов (46) в атоме этого элемента; в результате усиления отталкивания внешнего электрона внутренними внешний электрон серебра легче отщепляется, чем электрон меди.
Золото дает соединения, в которых имеет степень окисления +1 и +3. Свободные катионы золота неизвестны. Ионы этого элемента немедленно присоединяют в растворах те или иные анионы и образуют комплексные соединения, например:
КАuСl4; КАu(ОН)4; К[АuСl3(ОН)]; NaAu(CN)2
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'