
Водород - простое вещество
Получение водорода. Для получения обычного водорода существует много различных способов. К ним относится действие воды и кислот на металлы, действие растворов щелочей на амфотерные металлы, взаимодействие гидридов металлов с водой, процессы электролиза водных растворов щелочей, разделение компонентов водяного газа, конверсия углеводородов и их неполное окисление и др.:
Ca + 2H2О = Ca(OH)2+H2↑
6H2О + 2Al + 2NaOH = 2Na[Al(OH)4] + 3H2↑
Zn + H2SО4 = ZnSО4 + H2↑
LiH + H2О = LiOH + H2↑
Процесс образования водорода щелочными и щелочноземельными металлами при взаимодействии с водой сопровождается большим выделением теплоты. Оно настолько велико, что реакция с водой калия и более тяжелых металлов I группы, сопровождается самовоспламенением водорода.
Сравнительно немного кислот пригодно для получения водорода. Обычными сочетаниями кислота - металл, применяемыми для получения небольших количеств водорода, являются: цинк и серная кислота, цинк и соляная кислота, железо и соляная кислота, железо и серная кислота. Последнее сочетание использовалось на заре развития воздухоплавания для получения относительно больших объемов водорода, требовавшихся для наполнения воздушных шаров. В органической химии иногда применяют для целей восстановления олово с соляной кислотой. Магний реагирует с кислотами энергично и редко используется для получения водорода, азотную кислоту применять не следует, так как она восстанавливается водородом и практически выделяются только оксиды азота.
Действие щелочей на амфотерные металлы, например алюминий*:
* (Вообще говоря, в результате этой реакции получается смесь, где наряду с NaAlО2 получается и Na3[Al(OH)6], и Na[Al(OH)4].)
2Al + 2NaOH + 2H2О = 2NaA1О2 + 3H2,
облегчается за счет растворения в щелочах тонкой пленки гидроксида амфотерного металла, получающегося при действии на него воды. Гидриды натрия, кальция и других типичных металлов энергично реагируют с водой:
СаН2 + 2Н2О = Са(ОН)2 + 2Н2↑
В условиях военного времени эта реакция использовалась для быстрого пополнения запаса водорода в аэростатах.
Электролиз воды, точнее растворов щелочей (25 % раствора гидроксида натрия или 34 % раствора гидроксида калия), целесообразно производить лишь в тех местах, где дешевая электроэнергия. Механизм электролитического выделения водорода сложен и различен в зависимости от свойств среды и природы электрода, на котором происходит процесс. Если концентрация ионов водорода (ионов гидроксония) в растворе велика (т. е. раствор кислый), на катоде разряжаются ионы Н3О+ и образовавшиеся атомы Н рекомбинируют:
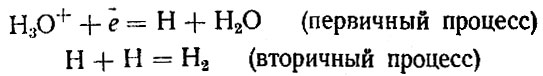
В щелочном растворе электроны, находящиеся на катоде, присоединяются к молекулам воды:
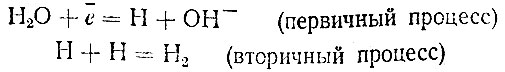
Фактически, по-видимому, всегда протекают оба процесса, но второй в кислых средах делается заметным лишь при больших плотностях тока. В особых условиях может происходить и присоединение электронов к моле* кулам кислот (угольной), в результате чего выделяется молекула водорода и получается анион кислоты:
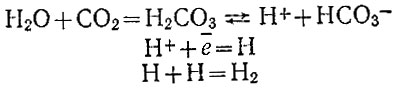
Водород входит в состав водяного газа - смеси, полученной пропусканием водяного пара над раскаленным углем:
Н2О + С=СО↑ + Н2↑
Эта реакция эндотермическая, поэтому часть газа сжигают для ее поддержания. Повторное смешивание с водяным паром полученного газообразного продукта и пропускание над железохромовым катализатором (при 550 °С) дает возможность превратить СО в СО2:
Н2О + СО = СО2 + Н2
Оксид углерода (IV) удаляют растворением в воде при повышенном давлении и таким образом получают практически чистый Н2.
В настоящее время водород получают из природного газа, попутных газов (коксовый газ, газы нефтепереработки) и электролизом воды. Получение водорода из природных газов основано на реакции углеводородов, содержащихся в этих газах с водяным паром (процесс конверсии). В качестве примера можно привести реакцию конверсии метана:
СН4+Н2О = СО + 3Н2
Эта реакция протекает с поглощением теплоты. Далее
оксид углерода (II) реагирует со второй молекулой воды:
СО + Н2О = СО2 + Н2
Конверсия метана ускоряется никелевым катализатором и протекает при 800° С. Для поддержания этой температуры приходится сжигать часть исходного газа.
Использование водорода. Из газов переработки нефти и коксового газа водород получают методом глубокого охлаждения, продукт содержит азот (около 15 %). Содержание азота повышают (до 25 %) и используют смесь непосредственно для синтеза аммиака. Главным потребителем водорода и является производство аммиака. Кроме того, значительное количество водорода идет для получения метанола, необходимого в химической промышленности. Метанол образуется из водорода и оксида углерода (II):
2Н2 + СО=СН3ОН
в присутствии катализаторов, содержащих оксиды переходных металлов. Главная роль принадлежит водороду при гидрогенизации жиров, масел и в производстве различных видов жидкого топлива. Нужен Н2 для синтеза хлороводорода в производстве соляной кислоты. Его смесь с кислородом используют при сварке, а в чистом виде в атомарных горелках. Применение водорода в качестве восстановителя лежит в основе технического метода получения некоторых металлов (например, вольфрама).
В последние годы в связи с удешевлением способов получения водорода и возрастанием общего потребления нефтепродуктов важное значение приобрела проблема использования водорода как горючего в двигателях. Водород представляет собой очень удобный источник энергии (точнее: его реакция с кислородом). При сгорании этого газа выделяется много теплоты, двигатель может развить большую мощность и в то же время продукты сгорания (водяной пар) абсолютно безвредны и не загрязняют окружающую среду.
Устройство электрохимического водородно-кислородного топливного элемента показано на рис. 4. Газы поступают в элемент, заполненный щелочным раствором, сквозь пористые угольные электроды, на которых происходят реакции:
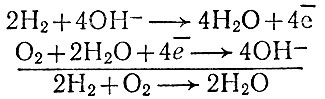
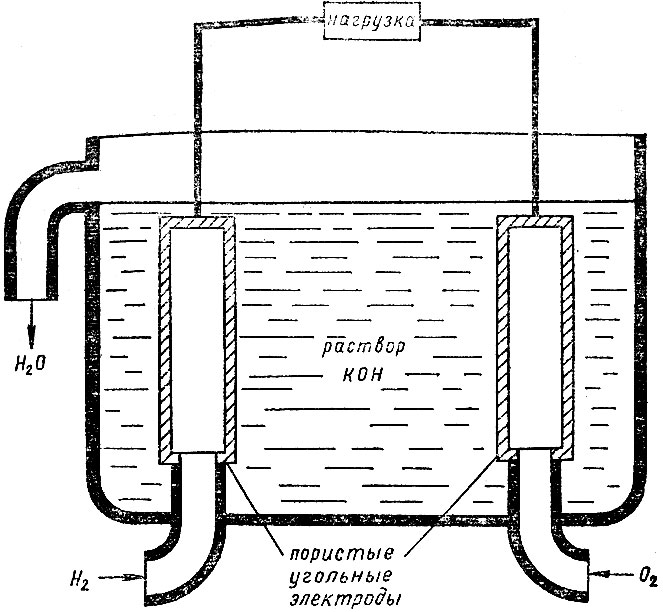
Рис. 4. Устройство водородно-кислородного топливного элемента
Водороду несомненно принадлежит в развитии энергетики большое будущее.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'