
Химические свойства водорода
Химики хорошо знают особенности молекулы водорода Н2, атома Н и иона Н+. Менее изучены свойства отрицательного иона Н- (гидридный ион), который содержится в молекулах соединений водорода с активными металлами (натрий, калий, кальций и др.).
Молекула водорода довольно прочна и в реакцию вступает лишь при условии, что реагирующие вещества получают небольшой избыток энергии. Так, водород соединяется с кислородом лишь при поджигании, и тогда реакция развивается быстро и бурно, а при определенном соотношении между объемами смешанных газов сопровождается сильнейшим взрывом (гремучий газ: два объема водорода на один объем кислорода). Можно и иным способом заставить водород вступить в реакцию с кислородом, именно: применить катализатор. Мельчайшие частицы металла платины действуют как ускорители реакции горения водорода. На поверхности этого металла кислород образует неустойчивое и активное поверхностное соединение, энергично реагирующее с водородом.
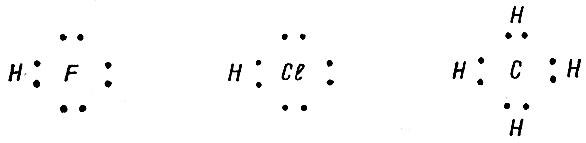
Следовательно, на пути прямой реакции водород + + кислород существует "барьер", который можно обойти, либо добавив энергию, либо применив катализатор. Такие барьеры просто означают, что для реакции нужно, чтобы сталкивающиеся молекулы (Н2 + О2) имели в момент столкновения избыток энергии (энергию активации). Катализатор ведет реакцию по иному пути (через оксиды платины), и на этом пути барьеров практически нет (они очень маленькие), и реакция проходит быстро (рис. 5). Атом водорода гораздо активнее молекулы*, потому что этот атом - радикал (его обозначают Н0), у него имеется один электрон, который не связан с другим. С элементами, атомы которых присоединяют электрон (например, с углеродом, галогенами, кислородом), водород реагирует с выделением значительных количеств теплоты и образует соединения, где он связан ковалентной связью. Так, например, реакция водорода с фтором, хлором, углеродом ведет к образованию молекул HF, НС1, СН4, электронное строение которых можно представить схемами:
* (Представление об энергетических эффектах, отвечающих образованию различных состояний водорода, можно получить, сопоставив тепловые эффекты следующих процессов:
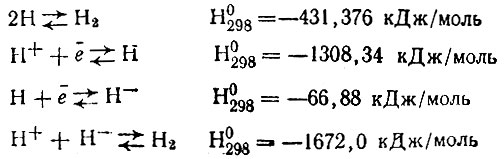
)
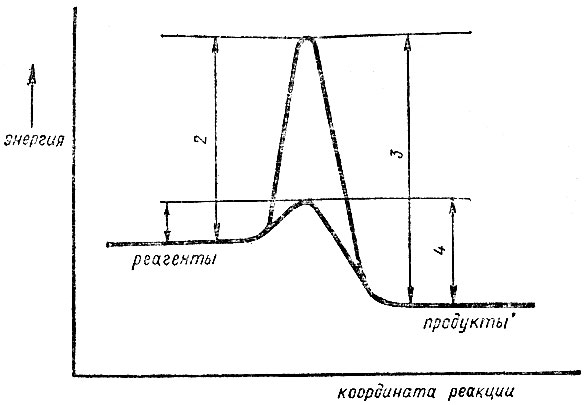
Рис. 5. Влияние катализатора на ход реакции: 1 - активационный барьер прямой реакции с катализатором, 2 - активационный барьер прямой реакции без катализатора, 3 - активационный барьер обратной реакции без катализатора, 4 - активационный барьер обратной реакции с катализатором
Эти вещества газообразны при обычных условиях. Между такими соединениями иногда происходит борьба за ион водорода. Так, при растворении НСl в воде молекула воды отрывает ион водорода Н+ от галогена и присоединяет его к паре электронов кислорода:
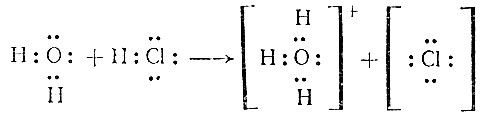
Получается хлористоводородная кислота. Поэтому ион водорода практически никогда не встречается в свободном состоянии - он всегда "прикреплен" к какой-либо паре электронов. Сочетание Н3O+ называется гидроксонием (по всем данным ион гидроксония в воде еще дополнительно соединен с тремя молекулами воды). В виде гидроксония ион водорода и действует в растворах. Поэтому, когда мы пишем в уравнениях реакции формулу иона водорода Н+, мы в сущности допускаем неточность надо было бы писать и молекулы того растворителя, в котором находится этот ион. В водном растворе спирта (этилового) ион водорода связан с молекулой С2Н5ОН так, что получается ион С2Н5ОН⋅Н+ - ион этоксония, с аммиаком и аминами образуются ионы типа NH4+ - аммоний или R - NH2 - Н+ у аминов. Присоединение иона водорода к молекулам различных соединений очень распространено в химии и биохимии и называется протонизацией. Соединения, содержащие ион Н- (гидридный ион) получаются при взаимодействии щелочных и щелочно-земельных металлов (металлы главной подгруппы второй группы) с водородом при нагревании. Реакция протекает довольно энергично и в результате получается белое кристаллическое вещество, проявляющее свойство соли. Водород, следовательно, в этом случае играет роль аниона:
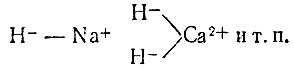
Гидриды щелочных и щелочно-земельных металлов - сильные восстановители, и с водой они выделяют водород:
NaH + H2О = NaOH + H2↑
В расплавленном состоянии гидриды проводят электрический ток и на аноде выделяется водородный гидридный ион.
Водород дает соединения с другими металлами, в том числе и с переходными, но строение их более сложно и там трудно выделить гидридный ион.
Водородная связь. Особенность электронного строения атома водорода приводит к тому, что в некоторых случаях водород способен образовывать своеобразную химическую связь, называемую водородной. Ее образование можно себе представить следующим образом. Если атом водорода связан в молекуле с сильно электроотрицательным элементом, таким, как фтор, кислород, азот (реже хлор и сера), то общая электронная пара в молекулах (HF, Н2О и т. п.) сильно смещена от водорода к атому электроотрицательного элемента. Положительный заряд протона водорода сконцентрирован в малом объеме. Протон действует своим положительным зарядом на соседнюю молекулу и может одновременно вступить во вторичную более слабую связь, взаимодействуя с неподеленной электронной парой другого атома или иона и частично обобществляя ее. Связь может быть как межмолекулярной, так и внутримолекулярной. В последнем случае она объединяет соседние группы атомов одной и той же молекулы.
Примером возникновения водородной связи может служить образование димеров воды и муравьиной кислоты, а также стабилизация структуры молекулы хлорфенола:
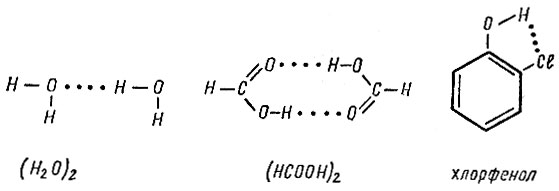
Водородную связь обычно обозначают точками, тем самым указывая, что она гораздо слабее (примерно в 15-20 раз) ковалёнтной связи. Энергия водородной связи, т. е. работа, которую необходимо затратить на ее разрыв, составляет всего 20-30 кДж/моль.
Когда явление водородной связи впервые было установлено в 1877 г. русскими химиками Н. Н. Бекетовым и М. А. Ильинским, оно не укладывалось в классические представления о строгой ограниченности валентности элементов. Это отразилось на названиях, которые давали открытому явлению: "неполное сродство", "дробная" или "делимая валентность", "побочная валентность", "вторичные силы" и т. д. Водородную связь сводили к простому электростатическому притяжению между протоном и другой полярной группой. Но сейчас ясно, что существенную роль здесь играет и донорно-акцепторное взаимодействие.
Водородная связь оказывает влияние на свойства многих химических соединений. Так, благодаря водородным связям фтороводород в обычных условиях (ниже 19,5° С) существует не в газообразном, а в жидком виде. Молекулы имеют состав от H2F2 до H6F6. Наличием водородных связей объясняются и необычные физические свойства воды. Вода - единственный оксид неметалла, находящийся при обычных условиях в жидком состоянии. Температура кипения воды (100° С) очень высока по сравнению с водородными соединениями других элементов подгруппы кислорода (H2S, H2Se, H2Te). Она превышает теоретически рассчитанное значение 80° С. У воды также большая плотность и большая теплоемкость. Все это указывает на значительную прочность связей между молекулами воды, для разрушения которых приходится затрачивать дополнительную энергию.
При температурах близких к 0°С в воде существуют молекулы состава (Н2О)8, с повышением температуры они распадаются на более простые: (Н2О)4 и (Н2О)2. Молекулы (H2О)2 встречаются в воде при 100 °С и даже в водяных парах. Свойством воды образовывать различные по структуре полимерные молекулы, более компактные или более объемистые, объясняется ее аномальное поведение при изменении температуры. Так, плавление льда сопровождается не расширением, как у подавляющего большинства веществ, а сжатием. При этом плотность воды несколько возрастает и только после 4°С начинает падать. Необычно меняется с температурой теплоемкость и другие свойства. Все эти явления связаны с тем, что при плавлении льда и дальнейшем нагревании происходит разрушение "рыхлой" структуры, образованной крупными ассоциатами воды, и переход к более компактным мелким ассоциатам.
Особенно большую роль водородные связи играют в молекулах белков, нуклеиновых кислот и других биологически важных соединений. Благодаря водородным связям, возникающим между карбонильными и аминогруппами ( -NH...O = C-), входящими в состав отдельных участков цепи биополимеров, осуществляется особая укладка молекулы в пространстве. Так, полипептидные цепи белков обычно находятся в виде винтовых спиралей (α-спиралей) или укладываются в β-структуры - "складчатые слои", которые образуются из нескольких участков растянутых цепей, лежащих антипараллельно друг к другу. Обе такие структуры удерживаются водородными связями (рис. 6).
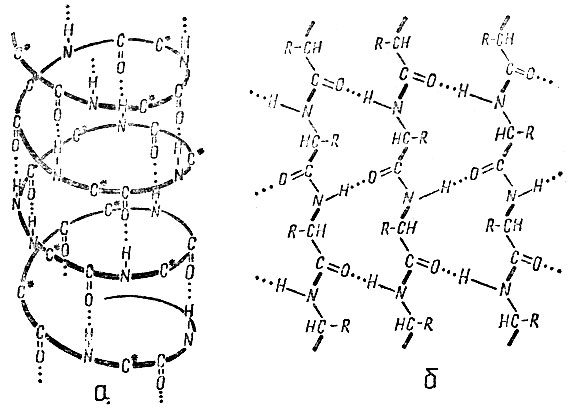
Рис. 6. Вторичная структура белка: а - α-спираль, б - β-структура
Молекулы так называемых фибриллярных белков, входящих в состав соединительных тканей, мышц, волос, обычно представляют собой вытянутую α-спираль и напоминают длинную пружину. Отдельные молекулы под действием возникающих между ними водородных связей скручиваются друг с другом подобно проводам в кабеле (рис. 7). Образующиеся при этом структуры действительно отличаются свойством пружины: они могут растягиваться до длины, вдвое превышающей их нормальную длину, и вновь сжиматься, когда нагрузка исчезает. Это происходит, например, при сжатии и растяжении мышц. Подобное поведение является следствием перестройки водородных связей. Добиться удлинения спиралеобразных молекул белка можно и другим путем - при увлажнении. Молекулы воды, внедряясь в структуру полипептидной цепи, нарушают водородные связи, и конформация белка меняется. На этом основано действие волосяного гигрометра. Он представляет собой обычный волос, натянутый грузиком, и перекинутый через подвижное колесо. Когда влажность воздуха в помещении увеличивается, волос удлиняется, колесо поворачивается и прикрепленный к нему указатель перемещается по шкале.
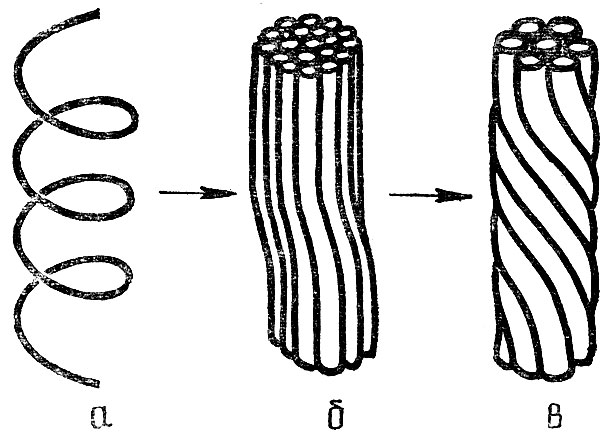
Рис. 7. Структура нити фибриллярного белка: а - спираль полипептидной цепи, б - третичная структура белка, в - четвертичная структура
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'