
Важнейшие соединения натрия
Можно без преувеличения сказать, что хлорид натрия - это один из фундаментальных камней всего огромного здания современной химической промышленности и технологии. Прозрачные с легким стеклянным блеском кубические кристаллы каменной соли довольно тверды: при ударе они раскалываются по плоскостям спайности, так что если удар был не очень сильным, то в результате получаются осколки правильной формы - кубы или параллелепипеды. Кристаллы плавятся при высокой температуре 801 °С и хорошо растворимы в воде. Раствор хлорида натрия прекрасно проводит электрический ток, так как он содержит ионы натрия (катионы) и ионы хлора (анионы). Высокая температура плавления, большая механическая прочность и заметная электрическая проводимость твердого кристаллического хлорида натрия указывают на то, что и кристаллы соли также содержат ионы.
Исследование кристаллов хлорида натрия рентгеновскими лучами показало, что ионы натрия и ионы хлора расположены там отнюдь не беспорядочно. Каждый ион натрия окружен шестью ионами хлора, а каждый ион хлора - шестью ионами натрия. Как это можно осуществить? На рис. 9 показано строение такого кристалла. По существу кристалл хлорида натрия состоит из двух "решеток": одна построена из ионов хлора, другая - из ионов натрия. Разместим мысленно по углам куба по одной частице (иону натрия или хлора все равно - решетки у них одинаковы), затем поместим по одной частице в середину каждой грани (т. е. на пересечении диагоналей квадратной грани). Получится так называемая гранецентрированная решетка. Две такие решетки (одна из ионов натрия, другая из ионов хлора) сдвинем так, чтобы расстояние между разными частицами (ионами хлора и натрия) было бы вдвое меньше, чем расстояние между одинаковыми частицами. Вот тогда и получится решетка, в которой каждая частица (ион) окружена шестью частицами, имеющими противоположный по знаку заряд. Следовательно, кристалл хлорида натрия представляет собой ионный кристалл, состоящий из сочетания двух гранецентрированных решеток. Этот тип решетки свойствен хлоридам и других щелочных металлов, за исключением цезия (см. ниже).
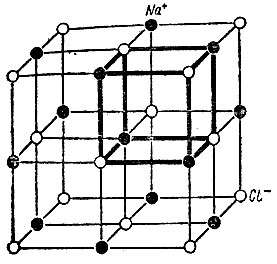
Рис. 9. Структура кристалла хлорида натрия
Перейдем теперь к техническим вопросам использования соединений натрия. Поваренная соль - важнейшее сырье для получения хлора. Из всех химических путей извлечения хлора из соли наиболее рациональным является тот, который основан на применении электрического тока. Ведь в хлориде натрия атом натрия лишен одного электрона, а атом хлора имеет один "лишний" электрон. Кажется вполне естественным отнять избыток электронов у хлора и вернуть потерянные электроны натрию. Именно это и может сделать электрический ток. Действительно, погрузим электроды в раствор соли и соединим с источником постоянного тока. В растворе хлорида натрия есть ионы хлора С1- и натрия Na+. Ионы хлора будут двигаться к аноду и там отдадут электрон положительно заряженному электроду;
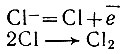
Мы получим в результате хлор в виде двухатомных молекул. Что же будет с ионами натрия? Они не разрядятся на катоде, вместо них разрядятся ионы водорода, которые также есть в растворе - они легче присоединяют электрон, чем ионы натрия. В итоге около катода образуется раствор щелочи - гидроксида натрия, а с поверхности катода будет выделяться газообразный водород. Итак, мы получили сразу три вещества - хлор, водород и гидроксид натрия. Все они находят себе широкое применение в химической промышленности, и. поэтому электрохимический способ получения хлора экономически выгоден. Но хлор - активное вещество, он может вступить в реакцию с гидроксидом натрия. Если хотят избежать этого, катодное и анодное пространство того сосуда, в котором ведется электролиз, разделяют специальной диафрагмой, препятствующей перемешиванию катодных и анодных растворов (католита и анолита), но позволяющие ионам двигаться в растворе по направлению к электродам.
Реакция между хлором и гидроксидом натрия ведет к образованию кислородных солей хлора NaClO, NaC1О3. Эти соли также представляют собой ценный продукт - они применяются для целей беления и др. Поэтому иногда, если имеют в виду получение белильных солей, намеренно перемешивают анолит и католит.
Очень удобно получение чистого гидроксида натрия с применением ртутных катодов. На ртути ионы водорода разряжаются с трудом, для их разряда необходимо приложить к электроду повышенный потенциал (создать "перенапряжение"). Ионы натрия, напротив, разряжаются легко, натрий соединяется со ртутью, образуя ряд соединений, которые можно условно обозначить NaHg. Раствор натрия в ртути называется амальгамой.
Гидроксид NaOH идет на мыловаренные заводы, его используют в производстве искусственного шелка, для очистки масел и нефти, в производстве красителей и лекарств. Большие количества гидроксида натрия потребляют заводы, производящие целлюлозу из древесины.
Древесную щепу, которая является сырьем, обрабатывают при нагревании раствором бисульфита кальция, содержащим диоксид серы; полученный продукт (сульфитная целлюлоза) подвергается очистке (облагораживанию) с помощью раствора гидроксида натрия. Очищенная целлюлоза идет и на изготовление вискозы (искусственного волокна), и на производство бумаги. Бумага в ваших тетрадях, книгах (в том числе и этой), газетах появилась на свет при деятельном участии гидроксида натрия.
Теперь займемся солью натрия, значение которой для химической промышленности очень велико. Слово "сода" знакомо всем, но не все знают, что это такое, и не всем известно, что под этим термином химики объединяют группу соединений.
Чистый безводный карбонат натрия Na2CО3 - это так называемая кальцинированная сода; сода кристаллическая - тот же карбонат, но содержащий кристаллизационную воду: Na2CО3·10Н2О; пищевая, питьевая двууглекислая сода в химии имеет точное название - гидрокарбонат натрия - это кислая соль NaHCО3.
В природных озерах встречаются отложения десятиводной соды Na2CO3-10H2O (натрон), соли состава Na2CО3·NaHCО3·2H2О (трона) и Na2CО3·H2О (термонатрит).
Мировое производство соды исчисляется десятками миллионов тонн в год. Мыловарение, производство стекла, кожевенная, фармацевтическая, текстильная промышленность, производство алюминия, лекарственных веществ и др. требуют огромных количеств соды.
Проблема быстрого и дешевого получения этой соли уже в XVIII в. стала одной из важных задач химической технологии. Французская академия наук в 1775 г. объявила конкурс на лучший способ производства соды. В 1791 -1792 гг. Леблан предложил способ, который стал основным в промышленности и сохранял свое значение в течение всего XIX в. Способ заключался в прокаливании смеси сульфата натрия с известняком и углем:
Na2SО4 + 2C + CaCО3 = Na2CО3+CaS + 2CО2
Полученную массу обрабатывали водой, растворяющей карбонат натрия. Примеси гидроксида натрия и сульфида натрия переводили в карбонат дополнительной обработкой раствора диоксидом углерода и окислителями. Раствор выпаривали и в остатке получали соду, прокаливанием ее можно было выделить и безводный продукт. Заметим, что для этого способа важно иметь сульфат натрия. Отходом производства является сульфид кальция. Его, однако, можно использовать для получения серы или серной кислоты.
В XX в. способ Леблана был вытеснен методом Сольвэ или аммиачно-хлоридным. Сырьем в этом методе служат хлорид натрия, оксид углерода (IV), аммиак и вода. Общее уравнение реакции можно записать так:
NaCl + NH4HCО3 = NaHCО3 + NH4Cl
Получается гидрокарбонат натрия и хлорид аммония. Процесс получения соды начинается с насыщения раствора хлорида натрия аммиаком. После этого следует стадия карбонизации - аммиачный раствор насыщают оксидом углерода (IV). В результате вышеуказанной реакции образуется гидрокарбонат натрия, который выпадает в осадок. Отфильтрованный осадок прокаливают; при этом гидрокарбонат теряет часть оксида углерода (IV) и превращается в товарный продукт, т. е. в соду.
Хлорид аммония обрабатывают раствором Са(ОН)2 в виде взвеси (так называемого известкового молока) и горячим паром. В результате реакции
2NH4Cl + Ca(OH)2 = 2NH3 + 2H2O + CaCl2
образуется газообразный аммиак, вновь используемый в производстве. Отходом, следовательно, является только хлорид кальция. Хлорид натрия можно заменить сульфатом натрия. Если работа ведется по этому способу, то, кроме соды, товарной продукцией будет также и сульфат аммония, применяемый, в частности, в качестве удобрения.
Соду получают также и в качестве побочного продукта при переработке нефелинов с целью извлечения оксида алюминия. Таким образом, хлорид, сульфат и карболат натрия тесно связаны в химической промышленности, и на их взаимных превращениях построены важные отрасли производства. Сульфат натрия относится к солям, которые с давних пор привлекают внимание химиков, инженеров и врачей.
Сульфат натрия был получен в XVII в. Иоганном Рудольфом Глаубером, сыном парикмахера, увлекавшимся химией и затратившим много труда на создание различных приборов и на получение новых веществ. Особенное внимание он уделял конструированию печей для химических целей. Одна из его книг (1648 г.) называется "Новые философские печи"; это прилагательное не должно вызывать недоумения - ведь слово "философский" означает "любящий мудрость", т. е. "ученый", и в нашем понимании заглавие труда И. Глаубера звучало бы как "Печи для научных целей". Пользуясь своими приборами, И. Глаубер исследовал кислоты и нашел, что при перегонке серной кислоты с хлоридом натрия можно получить соляную кислоту и соль, ранее не известную. Он установил, что она оказывает слабительное действие и назвал ее мирабелис, т. е. удивительная соль (отсюда и название природной самосадочной соли Na2SO4·10H2O мирабилит). Привилось, однако, название "глауберова соль", хотя последующие события показали, что сульфат натрия в самом деле заслуживает удивления по широте возможности его практического применения.
Уже в XVIII в. было выяснено, что сульфат натрия можно с успехом использовать для варки стекла. Нам трудно представить себе, что значило стекло для людей того времени. Тусклый свет, пробивавшийся через оконце, затянутое бычьим пузырем, был в большинстве домов единственным "средством общения" с внешним миром в короткие зимние дни, когда нельзя было это оконце открыть настежь. Лишь в богатых домах в оконные рамы владельцы вставляли куски более или менее прозрачной слюды. Стекло пользовалось громадным спросом, но стоило очень дорого.
В России в 1764 г. академик по экономии и химии К. Г. Лаксман установил, что глауберова соль способна образовывать стекло (в конце XVIII в. к тем же выводам пришел В. Лампадиус). До этого при изготовлении стекла пользовались древесной золой или поташем.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'