
Свойства простого вещества и соединений
Металлический цезий - мягкий металл светло-золотистого цвета, плавящийся при температуре 28,45 °С (кипит при 690 °С). Пламя горелки соединения цезия окрашивают в голубой цвет. На воздухе и в кислороде цезий воспламеняется, он разлагает воду с выделением водорода уже при - 116° С, а при температурах выше 300 °С действует даже на стекло, выделяя из него кремний. С различными окислителями цезий бурно реагирует. Реакции с серой и фосфором сопровождаются взрывом, при взаимодействии с галогенами цезий воспламеняется.
Отличительной особенностью галидов цезия является то, что они образуют иную, чем галиды других металлов I группы, кристаллическую решетку. Причина этого заключена в том, что тип кристаллической решетки в значительной степени определяется соотношением размеров входящих в нее ионов (rкат/rан). В случае больших по размеру ионов Cs+ предпочтительной становится упаковка, в которой у каждого иона оказывается восемь ближайших соседей, а не шесть, как в случае NaCl и др. Как видно из рис. 10, в кристалле CsCl ионы Cs+ расположены в узлах простой кубической решетки, а С1- - в узлах другой такой же решетки, обе решетки вложены друг в друга.
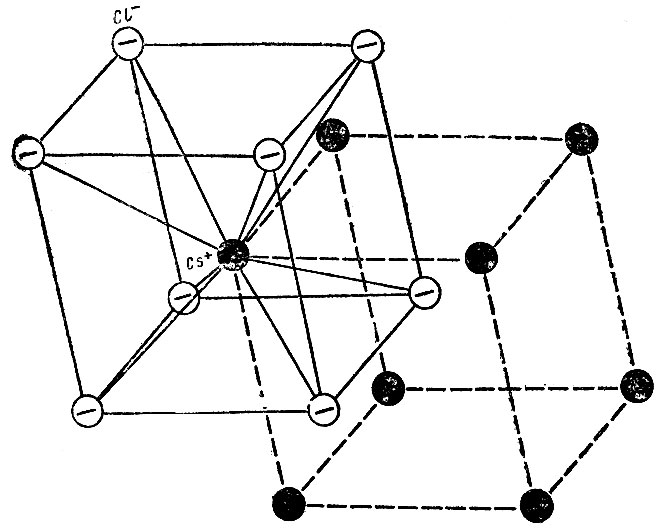
Рис. 10. Структура кристалла хлорида цезия
Простые соли цезия, особенно хлорид и сульфат, отличаются большой растворимостью в воде, тогда как двойные и комплексные соли растворимы очень мало. Со многими металлами цезий образует интерметаллические соединения.
Области использования. Цезий еще легче, чем рубидий, теряет электроны, и поэтому он в еще большей степени пригоден для изготовления фотоэлементов. Обычно применяют (для фотокатодов) соединение цезия и сурьмы CsSb. При освещении поверхности катода, покрытого этим соединением, из него вылетают электроны, и таким образом импульс света превращается в импульс электрического тока (рис. 11). Соединения цезия не токсичны.
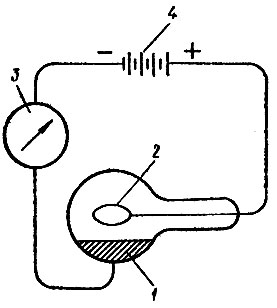
Рис. 11. Схема устройства фотоэлемента: 1 - зеркало из тонкого слоя соединения цезия; 2 - кольцо из платиновоя проволоки, соединенное с внешней цепью, 3 - гальванометр, 4 - вспомогательная батарея
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'