
Важнейшие соединения серебра
Соединения этого элемента разнообразны и многочисленны. Некоторые из них неустойчивы к действию света, что, как мы увидим, сыграло исключительно важную роль в развитии материальной культуры человечества.
Оксиды переходных металлов проявляют слабо основные свойства и непосредственно с водой не реагируют. Оксиды серебра не составляют исключение, но прочность гидроксида серебра настолько мала, что в обычных условиях AgOH вообще не существует. Удается обнаружить только следы его присутствия в воде, при взбалтывании порошка оксида Ag2O. Лишь при температуре - 50 °С при смешивании спиртовых растворов щелочи (КОН) и нитрата серебра получают белый осадок AgOH.
Серебро дает прочные соединения с галогенами: AgF, AgCl, AgBr, Agl.
Цвет их углубляется при переходе слеза направо в этом ряду. Фторид и хлорид - белые, бромид - желтоватый, а иодид отчетливо окрашен в желтый цвет. Это обстоятельство указывает на менее прочную связь электронов в бромиде и иодиде, чем в фториде и хлориде. Окраска указывает на поглощение света (видимой части спектра), т. е. на возможность перехода электронов соли на более высокие уровни.
Видимый свет несет небольшую энергию - большинство его квантов не способны поднять прочно связанные электроны на более высокий уровень во фториде и хлориде. Электроны в бромиде и иодиде размещены дальше от ядра (число электронных оболочек в атомах этих галогенов велико), уровни энергии их расположены теснее, и потому энергии кванта видимого света уже достаточно для переноса электрона на "возбужденный" уровень. Часть падающего света поглощается и отраженный имеет "окраску" - вещество кажется нам желтым. При длительном действии света, особенно, конечно, его ультрафиолетовых лучей, все галогениды серебра разлагаются. Кратковременное действие оставляет "следы" в частицах галогенидов серебра, незаметные на глаз, но облегчающие действие восстановителей. На этом явлении основан фотографический процесс.
Растворимость фторида серебра довольно велика --особенно резко выражен контраст между растворимостью фторида и этим же свойством других галогенидов серебра. В литре воды при 20 °С можно растворить 15 моль фторида и лишь одну десятитысячную долю моля хлорида. Растворимость бромида еще меньше (пять десятимиллионных долей моля), а растворимость иодида выражается уже миллиардными долями моля в литре. Заметим, что вообще свойства фтористых соединений своеобразны и резко отличаются от свойств соединений других галогенов. Эта особенность скорее характеризует индивидуальные черты фтора, чем серебра. Фторид серебра хорошо диссоциирует на ионы, чувствителен к ультрафиолетовым лучам и, выделяясь из водных растворов, образует кристаллогидраты с двумя и четырьмя молекулами воды на молекулу соли.
Интересно, что раствор фторида серебра реагирует с порошкообразным металлическим серебром при нагревании. В результате получается: AgF + Ag = Ag2F (субфторид серебра). Он представляет собой кристаллы (зеленоватого цвета), способные проводить электрический ток так же, как его проводят металлы, т. е. без разложения и за счет свободных электронов. Предполагают, что в кристаллах субфторида имеются группы, состоящие из одного иона фтора, зажатого между двумя ионами серебра: Ag+ F- Ag+. Между этими группами в кристалле движутся свободные электроны. Каждая группа соответствует, как видно, одному электрону.
Из других галогенидов упомянем о иодиде AgI. Его кристаллическая структура очень похожа на структуру кристаллов льда. Поэтому на частицах иодида серебра легко образуются кристаллы льда из переохлажденного пара. На этой особенности основано использование иодида для ускорения выпадения дождя. Хлорид серебра можно получить обменной реакцией соли серебра и какого-либо хлорида другого металла:
AgNO3 + KCl = AgCl + KNO3
Аналогично получаются и другие галогениды этого металла. К образованию соответствующих галогенидов ведет и прямое взаимодействие галогенов с серебром при нагревании:
F2 + 2 Ag = 2AgF (при красном калении)
Хлорид серебра может быть получен и другими путями. Например, в концентрированных растворах NaCl идет реакция:
4Ag + 4NaCl + O2 + 2H2O = 4AgCl + 4NaOH
В присутствии воздуха в результате этой реакции образуется хлорид серебра.
Из других солей серебра следует назвать нитрат - соль, которая хорошо растворима в воде и является обычным исходным веществом при изучении различных реакций ионов серебра. Нитрат серебра получается при взаимодействии азотной кислоты с металлическим серебром:
3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O
Эта реакция характерна для взаимодействий азотной кислоты с металлами переходного типа. Прежде всего проявляется сильно окислительное действие азотной кислоты. Можно схематически представить себе, что первым продуктом взаимодействия металла с кислотой будет оксид- в данном случае Ag2O. Азотная кислота, отдав металлу часть кислорода, образует продукт восстановления кислоты - оксид азота (II). Во второй стадии реакции Оксид реагирует с кислотой, давая соль (нитрат) и воду. Этот процесс с точки зрения электронных представлений можно представить так. Атом серебра отдает электрон: 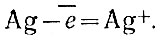 . Атом азота, имеющий степень окисления +5 в азотной кислоте, присоединяет три электрона и приобретает степень окисления
. Атом азота, имеющий степень окисления +5 в азотной кислоте, присоединяет три электрона и приобретает степень окисления 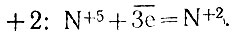 . Поэтому на один такой атом необходимо взять в реакции три атома серебра: получившиеся ионы серебра надо еще связать с тремя анионами МО3- (ведь получается соль AgNO3). Поэтому всего в реакцию входят четыре молекулы кислоты, но лишь одна из них подвергается восстановлению электронами серебра.
. Поэтому на один такой атом необходимо взять в реакции три атома серебра: получившиеся ионы серебра надо еще связать с тремя анионами МО3- (ведь получается соль AgNO3). Поэтому всего в реакцию входят четыре молекулы кислоты, но лишь одна из них подвергается восстановлению электронами серебра.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'