
Азот

Азот (лат. Nitrogenium) - химический элемент V группы периодической системы Менделеева; атомный номер 7, атомная масса - 14,0067
Бесцветный газ, без вкуса и запаха. Один из самых распространенных элементов, главная составляющая часть атмосферы Земли (4 х 1015 т).
Слово "азот", предложенное французским химиком А. Лавуазье в конце XVIII в., греческого происхождения. "Азот" означает "безжизненный" (приставка "а" - отрицание, "зоэ" - жизнь). Именно так считал Лавуазье. Именно так считали его современники, в том числе шотландский химик и врач Д. Резерфорд, выделивший азот из воздуха чуть раньше своих известных коллег - шведа К. Шееле, англичан Д. Пристли и Г. Кавендиша. Резерфорд в 1772 г. опубликовал диссертацию о так называемом "мефитическом", т.е. неполноценном, воздухе, не поддерживающем горения и дыхания.
Название "азот" для нового газа казалось достаточно точным. Но так ли это?
Азот действительно, в отличие от кислорода, не поддерживает дыхания и горения. Однако дышать чистым кислородом постоянно человек не может. Даже больным дают чистый кислород лишь непродолжительное время. На всех советских орбитальных станциях, на космических кораблях "Союз" и "Восток" космонавты дышали привычным атмосферным воздухом, почти на 4/5 состоящим из азота. Очевидно, он не просто нейтральный разбавитель кислорода. Именно смесь азота с кислородом наиболее приемлема для дыхания большинства обитателей нашей планеты.
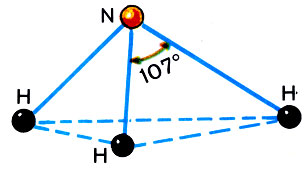
Строение молекулы аммиака NH3
А разве справедливо называть безжизненным этот элемент? Чем подкармливают растения, внося минеральные удобрения? Прежде всего соединениями азота, калия и фосфора. Азот входит в состав бесчисленного множества органических соединений, в том числе таких жизненно важных, как белки и аминокислоты.
Для человечества чрезвычайно полезна относительная инертность этого газа. Будь он более склонен к химическим реакциям, атмосфера Земли не могла бы существовать в том виде, в каком она существует. Сильный окислитель кислород вступил бы с азотом в реакцию, и образовались бы ядовитые оксиды азота. Но если бы азот был действительно инертным газом, таким, например, как гелий, то тогда ни химические производства, ни всемогущие микроорганизмы не смогли бы связать азот атмосферы и удовлетворить потребность всего живого в связанном азоте. Не было бы аммиака, азотной кислоты, необходимой для производства множества веществ, не было бы важнейших удобрений. Не было бы и жизни на Земле, ведь азот входит в состав всех организмов. На долю азота приходится около 3% от массы человеческого организма.
Элементарный, не связанный азот применяется достаточно широко. Это самый дешевый из газов, химически инертных в обычных условиях, поэтому в тех процессах металлургии и большой химии, где надо защищать активное соединение или расплавленный металл от взаимодействия с кислородом воздуха, создают чисто азотные защитные атмосферы. Под защитой азота хранят в лабораториях легко окисляющиеся вещества. В металлургии азотом насыщают поверхности некоторых металлов и сплавов, чтобы придать им большую твердость и износоустойчивость. Широко известно, например, азотирование стали и титановых сплавов.

Круговорот азота в природе
Жидкий азот (температуры плавления и кипения азота: - 210°С и - 196°С) используют в холодильных установках.
Малая химическая активность азота объясняется прежде всего строением его молекулы. Как и у большинства газов (кроме инертных), молекула азота состоит из двух атомов. В образовании связи между ними участвуют по 3 валентных электрона внешней оболочки каждого атома. Чтобы разрушить молекулу азота, необходимо затратить очень большую энергию - 954,6 кДж/моль. Без разрушения молекулы азот в химическую связь не вступит. При обычных условиях с ним способен вступить в реакцию только литий, давая нитрид Li3N.
Намного активнее атомарный азот. При обычной температуре он вступает в реакции с серой, фосфором, мышьяком и некоторыми металлами, например со ртутью. Но получить азот в виде отдельных атомов сложно. Даже при 3000°С не наблюдается заметного разложения молекул азота на атомы.
Соединения азота имеют громадное значение и для науки, и для многих отраслей промышленности. Ради получения связанного азота человечество идет на огромные энергетические затраты.
Синтез аммиака идет в гигантских колоннах синтеза, куда с помощью компрессора подается смесь водорода и азота. Реакция протекает под давлением в 300 ат и температуре около 500°С в присутствии катализатора. Образовавшийся аммиак NH3 в холодильнике превращается в жидкость (конденсируется). Жидкий аммиак удаляется из системы, а непрореагировавшие газы поступают в циркуляционный насос, который снова подает их в колонну синтеза.
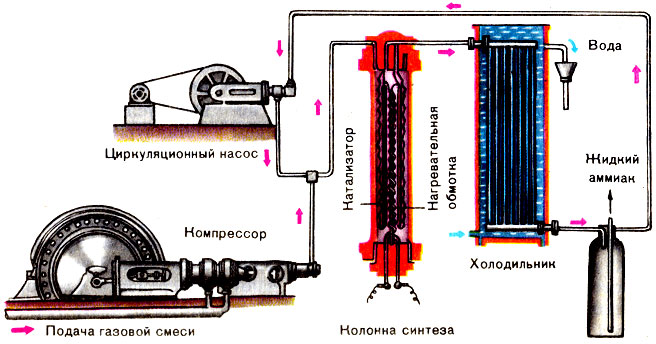
Основным способом связывания азота в промышленных условиях остается синтез аммиака NH3 (см. Синтез химический). Аммиак - один из самых массовых продуктов химической промышленности, мировое производство его - более 70 млн. т в год. Процесс идет при температуре 400-600 С и давлении в миллионы паскалей (сотни ат) в присутствии катализаторов, например губчатого железа с добавками оксида калия, оксида алюминия. Сам аммиак используется ограниченно и обычно в виде водных растворов (аммиачная вода - как жидкое удобрение, нашатырный спирт - в медицине). Но аммиак, в отличие от атмосферного азота, довольно легко вступает в реакции присоединения и замещения. Да и окисляется он легче, чем азот. Поэтому аммиак и стал исходным продуктом для получения большинства азотсодержащих веществ.
Прямое окисление азота кислородом требует очень высоких температур (4000°С) или других очень активных методов воздействия на прочные молекулы азота - электрического разряда, ионизирующего излучения. Известны пять оксидов азота: N2O оксид азота (I), NO оксид азота (II), N2O3 оксид азота (III), NO2 оксид азота (IV), N2O5 оксид азота (V).
В промышленности широко применяется азотная кислота HNO3, которая одновременно является и сильной кислотой, и активным окислителем. Она способна растворять все металлы, кроме золота и платины. Химикам азотная кислота известна по крайней мере с XIII в., ею пользовались древние алхимики. Азотная кислота чрезвычайно широко используется для получения нитросоединений. Это главный нитрующий агент, с помощью которого в состав органических соединений вводят нитрогруппы NO2. А когда три таких группы появятся, к примеру, в молекуле толуола С6Н5СН3, то обычный органический растворитель превращается во взрывчатое вещество - тринитротолуол, тротил, или тол. Глицерин после нитрования превращается в опасное взрывчатое вещество - нитроглицерин.
Не менее важна азотная кислота в производстве минеральных удобрений. Соли азотной кислоты-нитраты, прежде всего нитраты натрия, калия и аммония, используются главным образом как азотные удобрения. Но, как установил академик Д. Н. Прянишников, растение, если ему предоставлена возможность выбора, предпочитает аммиачный азот нитратному.
Соли другой кислоты азота - слабой азотистой HNO2 - называются нитритами и также довольно широко используются в химической и других отраслях промышленности. Нитрит натрия, например, в небольших дозах добавляют в колбасы и ветчину, чтобы сохранить присущий мясу розово-красный цвет.
Получать соединения азота с минимальными энергетическими затратами при небольших температурах и давлениях ученые стремятся уже давно. Идею о том, что некоторые микроорганизмы могут связывать азот воздуха, первым высказал русский физик П. Коссович в конце XIX в., а выделил из почвы первую азотфиксирующую бактерию другой наш соотечественник - биохимик С. Н. Виноградский в 1890-е гг. Но лишь в последнее время стал более или менее ясен механизм связывания азота бактериями. Бактерии усваивают азот, превращая его в аммиак, который затем очень быстро превращается в аминокислоты и белки. Процесс идет при участии ферментов.
В лабораториях нескольких стран (в СССР в начале 60-х гг.) получены комплексные соединения, способные связывать атмосферный азот. Главная роль при этом отводится комплексам, содержащим молибден, железо и магний. В основном уже изучен и разработан механизм этого процесса.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'