
Бериллий
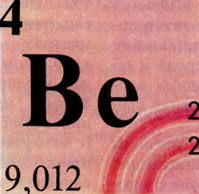
Бериллий (лат. Beryllium) - химический элемент II группы периодической системы Менделеева; атомный номер 4, атомная масса 9,012
Бериллий был обнаружен в 1798 г. знаменитым французским химиком Л. Вокленом в полудрагоценном камне берилле. Отсюда и название элемента. Впрочем, Воклен выделил только новую "землю" - оксид неизвестного металла. Относительно чистый бериллий в виде порошка был получен только через 30 лет независимо Ф. Вёлером в Германии и Э. Бюсси во Франции.
Долгое время многие химики считали, что бериллий - трехвалентный металл с атомной массой 13,8. Для такого металла не находилось места в периодической системе, и тогда, несмотря на очевидное сходство бериллия с алюминием, Д. И. Менделеев поместил этот элемент во вторую группу, изменив его атомную массу на 9. Вскоре шведские ученые Л. Нильсон и О. Петерсон нашли, что атомная масса бериллия 9,1, что соответствовало предположениям Д. И. Менделеева.
Бериллий - редкий элемент, его содержание - 6⋅10-4% от массы земной коры. Из соединений бериллия чаще всего встречается берилл Ве3А12 (SiO3)6. Бериллий входит в состав и других природных соединений. Среди них - драгоценные камни: изумруд, аквамарин, гелиодор, которые использовали для украшений еще в древности.
Чистый бериллий - светло-серый, легкий, твердый и хрупкий металл. Бериллий химически активен, атом его легко отдает свои 2 электрона с внешней оболочки (степень окисления + 2). На воздухе бериллий покрывается оксидной пленкой, ВеО, предохраняющей его от коррозии и очень тугоплавкой, а в воде - пленкой Ве(ОН)2, которая также защищает металл. Бериллий реагирует с серной, соляной и другими кислотами (с азотной взаимодействует только при нагревании). Легко соединяется с галогенами, серой и углеродом.
Во второй половине XX в. бериллий стал необходим во многих отраслях техники. Этот металл и его сплавы отличаются уникальным сочетанием различных свойств. Конструкционные материалы на основе бериллия обладают одновременно и легкостью, и прочностью, и стойкостью к высоким температурам. Будучи в 1,5 раза легче алюминия, эти сплавы в то же время прочнее многих специальных сталей. Эти качества и сам бериллий, и многие его сплавы не утрачивают при температуре 700-800°С, поэтому они используются в космической и авиационной технике.
Бериллий необходим и в атомной технике: он стоек к радиации и выполняет роль отражателя нейтронов.
Недостатками бериллия следует считать его хрупкость и токсичность. Все соединения бериллия ядовиты. Известно специфическое заболевание - бериллиоз, при котором поражаются многие системы живого организма и даже скелет.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'