
Вода
Вода Н2O - вещество привычное и необычное. Известный советский ученый академик И. В. Петрянов свою научно-популярную книгу о воде назвал "Самое необыкновенное вещество в мире" (М.: Педагогика, 1981). А "Занимательная физиология", написанная доктором биологических наук Б. Ф. Сергеевым (М.: Мол. гвардия, 1979), начинается с главы о воде - "Вещество, которое создало нашу планету".
Ученые абсолютно правы: нет на Земле вещества, более важного для нас, чем обыкновенная вода, и в то же время не существует другого такого вещества, в свойствах которого было бы столько противоречий и аномалий, сколько в ее свойствах.
Почти ¾ поверхности нашей планеты занято океанами и морями. Твердой водой - снегом и льдом - покрыто 20% суши. От воды зависит климат планеты. Геофизики утверждают, что Земля давно бы остыла и превратилась в безжизненный кусок камня, если бы не вода. У нее очень большая теплоемкость. Нагреваясь, она поглощает тепло; остывая, отдает его. Земная вода и поглощает, и возвращает очень много тепла и тем самым "выравнивает" климат. А от космического холода предохраняют Землю те молекулы воды, которые рассеяны в атмосфере - в облаках и в виде паров...
Но не только поэтому мы считаем воду жизненно важным веществом. Дело в том, что тело человека почти на 63-68% состоит из воды. Практически все биохимические реакции в каждой живой клетке - это реакции в водных растворах... В растворах же (преимущественно водных) протекает большинство технологических процессов на предприятиях химической промышленности, в производстве лекарственных препаратов и пищевых продуктов. И в металлургии вода чрезвычайно важна, причем не только для охлаждения. Не случайно гидрометаллургия - извлечение металлов из руд и концентратов с помощью растворов различных реагентов - стала важной отраслью промышленности.

Точки кипения и замерзания четырех гидридов элементов. Температуры кипения и замерзания воды аномально высоки. Строение молекулы воды
Разная бывает вода: жидкая, твердая и газообразная; пресная и соленая; свободная и связанная. В конце 60-х - начале 70-х гг. XX в. в статьях и книгах часто можно было встретить термин "аномальная вода". Потом от него отказались, но это не исключило множества аномалий в физических и, в меньшей мере, химических свойствах обычной, "нормальной" воды.

Схема растворения ионного кристалла
Как известно, свойства химических соединений зависят от того, из каких элементов состоят их молекулы, и изменяются закономерно. Воду можно рассматривать как оксид водорода или как гидрид кислорода. Проследим, как изменяются температуры плавления и кипения водородных соединений элементов главной подгруппы VI группы таблицы Менделеева (см. Периодическая система химических элементов):
| Теллуроводород | Селеноводород | Сероводород | Вода | |
|---|---|---|---|---|
| H2Te | H2Se | H2S | H2O | |
| Tпл. | -51° | -64° | -82° | 0°С |
| Tкип. | -4° | -42° | -61° | 100°C |
"Нелогичность" поведения воды особенно ярко видна при изображении этой зависимости на графике. Получается, что переходы воды из твердого состояния в жидкое и газообразное происходят при температурах, намного более высоких, чем следовало бы.
Этим аномалиям найдено объяснение. Молекула воды Н2O построена в виде тупоугольного треугольника: угол между двумя связями кислород - водород 104°27' (см. рисунок). Но поскольку оба водородных атома расположены по одну сторону от кислородного, электрические заряды в ней рассредоточиваются. Молекула воды полярна (см. Химическая связь), что является причиной особого взаимодействия между разными ее молекулами. Атомы водорода в молекуле Н2O, имея частичный положительный заряд, взаимодействуют с электронами атомов кислорода соседних молекул. Такая химическая связь называется водородной. Она объединяет молекулы Н2O в своеобразные полимеры пространственного строения; плоскость, в которой расположены водородные связи, перпендикулярна плоскости атомов той же молекулы Н2O. Взаимодействием между молекулами воды и объясняются в первую очередь незакономерно высокие температуры ее плавления и кипения. Нужно подвести дополнительную энергию, чтобы расшатать, а затем разрушить водородные связи. И энергия эта очень значительна. Вот почему, кстати, так велика теплоемкость воды.
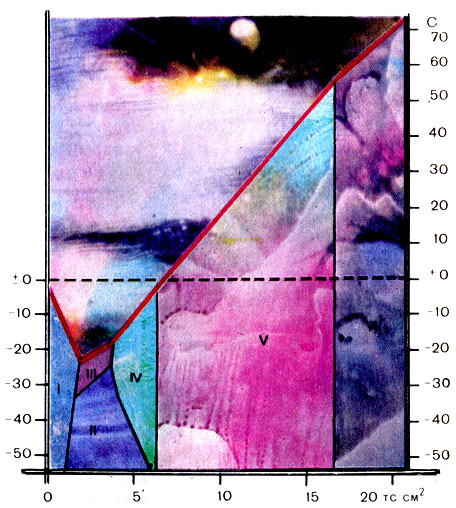
Фазовая диаграмма воды. Римские цифры - модификации льда
Советский ученый В. И. Вернадский писал: "Вода стоит особняком в истории нашей планеты. Нет природного тела, которое могло бы сравниться с ней по влиянию на ход основных, самых грандиозных, геологических процессов. Нет земного вещества-минерала, горной породы, живого тела, которое ее бы не заключало. Все земное вещество.. .ею проникнуто и охвачено".
Из подобных же молекулярных ассоциатов (объединений молекул) состоят и кристаллы обычного льда. "Упаковка" атомов в таком кристалле неплотная, и лед плохо проводит тепло. Плотность жидкой воды при температуре, близкой к нулю, больше, чем у льда. При 0°С 1 г льда занимает объем 1,0905 см3, a 1 г жидкой воды - 1,0001 см3. И лед плавает, оттого и не промерзают обычно насквозь водоемы, а лишь покрываются ледяным покровом. В этом проявляется еще одна аномалия воды: после плавления она сначала сжимается, а уж потом, на рубеже 4°С, при дальнейшем нагреве начинает расширяться.
При высоких давлениях обычный лед можно превратить в так называемые лед - II, лед - III и т. д. - более тяжелые и плотные кристаллические формы этого вещества. Самый твердый, плотный и тугоплавкий пока - лед-VII - получен под давлением 3 млрд. Па. Он плавится при + 190°С.
Из химических свойств воды особенно важны способность ее молекул диссоциировать (распадаться) на ионы и способность воды растворять вещества разной химической природы. Роль воды как главного и универсального растворителя определяется прежде всего полярностью ее молекул (смещением центров положительных и отрицательных зарядов) и, как следствие, ее чрезвычайно высокой диэлектрической проницаемостью. Разноименные электрические заряды, и в частности ионы, притягиваются друг к другу в воде в 80 раз слабее, чем притягивались бы в воздухе. Силы взаимного притяжения между молекулами или атомами погруженного в воду тела также слабее, чем на воздухе. Тепловому движению в этом случае легче разобщить молекулы. Оттого и происходит растворение, в том числе многих труднорастворимых веществ: капля камень точит...
Диссоциация (распадение) молекул воды на ионы: Н2O → Н+ + ОН-, или 2Н2O → Н3О+ (ион гидроксония) + ОН- в обычных условиях крайне незначительна; диссоциирует в среднем одна молекула из 500000000. При этом надо иметь в виду, что первое из приведенных уравнений сугубо условное: не может существовать в водной среде лишенный электронной оболочки протон Н +. Он сразу соединяется с молекулой воды, образуя ион гидроксония Н3О+. Считают даже, что ассоциаты водных молекул в действительности распадаются на значительно более тяжелые ионы, такие, например, как: 8Н2O → Н9O+4 + Н7O-4, а реакция Н2O → Н+ + ОН- - лишь сильно упрощенная схема реального процесса.
Реакционная способность воды сравнительно невелика. Правда, некоторые активные металлы способны вытеснять из нее водород:
2Na + 2Н2O → 2NaOH + Н2↑,
а в атмосфере свободного фтора вода может гореть:
2F2 + 2Н2O → 4HF + O2
На вопрос, много ли воды на Земле, ученые отвечают: очень много и очень мало одновременно. Почему много - очевидно: океаны, ледники, реки, дожди... А вот почему мало? Потому что потребности человечества в воде сегодня уже сравнимы с возобновляемыми ресурсами пресной воды на нашей планете. Потому что в процессах производства и жизнедеятельности мы загрязняем больше воды, чем очищаем. Потому что большая часть земной воды не вода вовсе, а достаточно концентрированные солевые и иные растворы.
Поэтому необходимо беречь воду.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'