
Гидролиз
Гидролиз в широком смысле слова - это реакции обменного разложения между различными веществами и водой. Такое определение охватывает как гидролиз неорганических веществ, так и органических - сложных эфиров, жиров, углеводов, белков.
Наиболее подробно изучен гидролиз солей. Любую соль можно представить как продукт взаимодействия кислоты и основания. Например, ацетат натрия CH3COONa образован слабой кислотой СН3СООН и сильным основанием NaOH; хлорид аммония NH4Cl - сильной кислотой НО и слабым основанием NH4OH; ацетат аммония CH3COONH4 - слабой кислотой СН3СООН и слабым основанием NH4OH, а хлорид натрия NaCl - сильной кислотой НС1 и сильным основанием NaOH.
Соли, как ионные соединения, в водном растворе полностью диссоциируют на ионы (см. Электролитическая диссоциация.) И те ионы, которые с водой образуют слабые электролиты, нарушают равновесие воды с Н+ и ОН- - ионами, т. е. делают раствор щелочным или кислым. Поэтому очень часто гидролиз солей определяют как взаимодействие ионов соли с водой, приводящее к образованию слабого электролита. Но такое определение относится только к солям.
Различают четыре случая взаимодействия солей с водой.
1. Соли, образованные слабой кислотой и сильным основанием, подвергаются гидролизу, и раствор приобретает щелочную реакцию (рН > 7, см. Водородный показатель). Примером может быть взаимодействие CH3COONa с Н2O. Уравнение гидролиза можно записать так:
СН3СОО- + Н2О ↔ СН3СООН + ОН-
Здесь образовался слабый электролит СН3СООН, в избытке - гидроксид-ионы ОН-.
2. Соли, образованные сильной кислотой и слабым основанием, также подвергаются гидролизу, и раствор приобретает кислую реакцию (рН < 7). Примером будет NH4Cl. Уравнение гидролиза:
NH+4 + Н2O ↔ NH4OH + H+
В этом случае образовался гидроксид аммония, обладающий свойствами слабого основания.
3. Наиболее полному гидролизу подвергаются соли, образованные слабой кислотой и слабым основанием, например CH3COONH4. Ионы этих солей одновременно связывают Н+ и ОН- - ионы, смещая равновесие диссоциации воды:
СН3СОО- + NH+4 + Н2O · СН3СООН + NH4OH
Реакция раствора зависит от степени (константы) диссоциации продуктов гидролиза (см. Электролитическая диссоциация); в данном примере - реакция практически нейтральная, так как константы диссоциации почти равны: KСН3СООН = 1,75 · 10-5 и KNH4OH = 1,76 · 10-5.
4. Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются (рН7). Ионы таких солей, например NaCl, не могут образовывать с водой слабых электролитов, и концентрация Н+ и ОН- - ионов в растворе остается такой же, как и у чистой воды.
Помимо солей гидролизу подвергаются некоторые простые вещества, карбиды, галоген-ангидриды (см. Ангидриды), минералы и другие неорганические вещества.
Гидролиз органических веществ обычно осуществляется в присутствии катализаторов - минеральных кислот, щелочей, ферментов (в организме). Например:
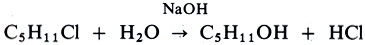
В больших масштабах осуществляется гидролиз древесины. Растущая быстрыми темпами гидролизная промышленность вырабатывает из непищевого сырья (древесины, хлопковой шелухи, подсолнечной лузги, соломы, кукурузной кочерыжки) ряд ценных продуктов: этиловый спирт, белковые дрожжи, глюкозу, твердый оксид углерода (IV), фурфурол, скипидар, метиловый спирт и др.
В живых организмах протекает гидролиз полисахаридов, белков и других органических соединений. Гидролизом обусловлено существование буферных систем, поддерживающих постоянную кислотность среды.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'