
Йод

Йод (лат. Iodum) - химический элемент VII группы периодической системы Менделеева; атомный номер 53, атомная масса 126,904
Йод относится к семейству галогенов. Он был открыт в 1811 г. Первооткрывателем его стал дотоле неизвестный в научных кругах французский химик-технолог Б. Куртуа. Кур-туа получил "новое вещество... в виде черного порошка, превращающегося при нагревании в пары великолепного фиолетового цвета". Название новому элементу дал известный физик и химик Ж. Гей-Люссак. "Иоэйдэс" в переводе с древнегреческого означает "фиолетовый" - по цвету паров нового вещества.
Йод - элемент достаточно редкий (его запасы 4 · 10-5% от массы земной коры) и рассеянный. Промышленных месторождений иодсодержащих минералов на Земле нет. Получают иод из золы морских водорослей, способных накапливать соединения этого элемента. Самая известная из них - морская капуста ламинария. Получают его из природных иодсодержащих растворов - попутных нефтяных вод, соленой воды некоторых озер. Больше всего иода сосредоточено в водах Мирового океана, но концентрация его там невысока. При испарении морской воды часть иода переходит в воздух и разносится в атмосфере. Замечено, что в районах, удаленных от моря, чаще наблюдаются заболевания щитовидной железы, связанные с недостатком иода в организме.
Опыт по выгонке йода
Хронический недостаток иода вызывает серьезные нарушения обмена веществ. Вот почему в СССР и во многих других странах для профилактики различных заболеваний к продаваемой поваренной соли добавляют небольшие количества иодидов - солей иодоводорода. А в медицинской практике водные и спиртовые растворы иода как антисептики начали применять еще во второй половине XIX в. В наши дни настойка иода (его 5%-ный спиртовой раствор) - обязательная принадлежность любой домашней аптечки. Но, пользуясь иодом, необходимо помнить, что в больших дозах иод вызывает ожоги и отравления.
В обычных условиях иод находится в твердом состоянии. Элементарный иод-кристаллы черно-серого цвета с металлическим блеском.
Молекула иода двухатомна I2.
Йод лучше, чем его более легкие соседи по группе, проводит электрический ток. Проводят электричество и водные растворы иода.
В парообразное состояние иод перевести значительно легче, чем в жидкое. Если при нормальном давлении его медленно нагревать, то кристаллы возгонятся, превратятся в пар, минуя жидкое состояние.
Как окислитель иод слабее, чем фтор, хлор, кислород, бром. Тем не менее он вступает в реакции со множеством простых и сложных веществ, проявляя в соединениях степени окисления - 1 (чаще всего, например, в KI); + 1(НIO), +3(lСl3); +5(НIO3), +7(Н5IO6).
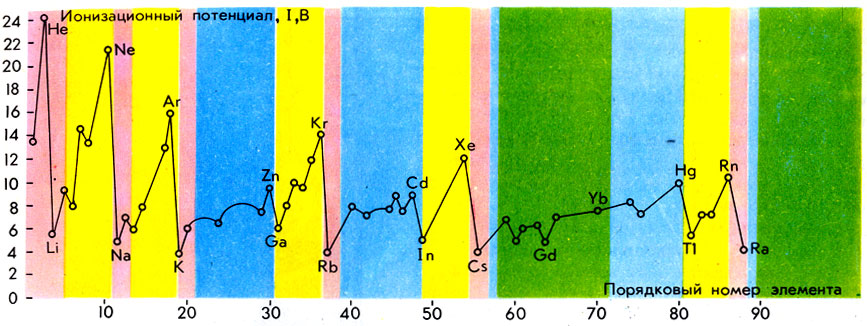
График зависимости ионизационных потенциалов атомов различных химических элементов от зарядов ядер
Соединения иода применяются достаточно широко: в производстве фотоматериалов и специального стекла, в химической промышленности и особенно в медицине и фармацевтической промышленности.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'