
Катализ
Катализ - явление, заключающееся в ускорении химических реакций под влиянием веществ, которые не изменяются в результате реакции. Эти вещества-ускорители называют катализаторами. Катализаторы активно участвуют в химическом процессе, образуя промежуточные соединения с исходными веществами, но в конечном счете вновь восстанавливаются, приобретая тот же состав, что был до реакции.
Схематически действие катализатора (К) на реакцию превращения вещества А в вещество В можно представить так:
без катализатора: А → В;
с катализатором: А + К → М (промежуточное соединение); М → В + К.
Человек наблюдал действие катализаторов брожения при образовании вина и уксуса из виноградного сока или действие дрожжей в хлебопекарном производстве еще в древние времена. Трудности изучения катализа, наблюдаемого в природе, объясняются тем, что природные катализаторы - ферменты имеют очень сложный состав (см. Белки) и их нелегко выделить в чистом виде. Успехи химии в XIX в. позволили изучить каталитические реакции, в которых катализаторами служили металлы (платина, железо, серебро, медь и др.), их оксиды, сульфиды и другие соли.
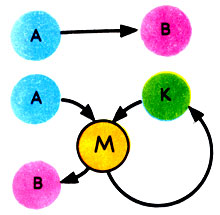
Общая схема катализа
Каталитические свойства платины в реакциях окисления можно продемонстрировать в простом опыте (под тягой) (рис. 1). Зажигают газовую горелку и накаляют докрасна в пламени небольшую платиновую пластинку, удерживая ее пинцетом. Закрывают кран горелки, дают пламени погаснуть, а затем вновь открывают кран так, чтобы струя газа попала на пластинку. Пластинка снова раскаляется докрасна! Горение (окисление) газа протекает теперь только на поверхности металла - катализатора.
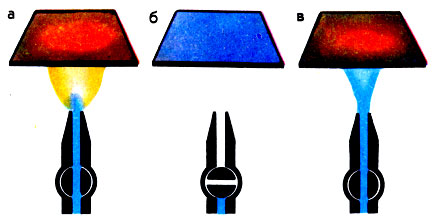
Платиновая пластинка предварительно нагретая (а), катализирует окисление метана в светильном газе (б) и раскаляется докрасна (в)
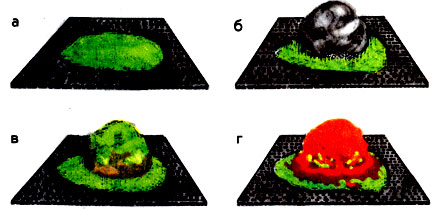
Для демонстрации каталитических свойств оксидов можно воспользоваться свежеполученным оксидом хрома Сr2О3. Помещают щепотку оксида хрома (III) на асбестовую сетку и сверху кладут небольшой клочок ваты, пропитанный спиртом или ацетоном. Затем всю вату засыпают тем же оксидом хрома (III) и подносят зажженную спичку к поверхности порошка. Окисление паров спирта протекает только на поверхности катализатора: оксид сильно раскаляется (это поверхностное горение) (рис. 2).
В теории катализа большое значение имеет изучение состава и свойств тех промежуточных соединений, которые обозначены в приведенном выше уравнении буквой М. Так, например, в реакции превращения уксусной кислоты в ацетон:
2СН3СООН → (СН3)2СО + Н2О + СО2
катализатором служит карбонат кальция СаСО3. Доказано, что это вещество сначала образует с уксусной кислотой соль Са(СН3СОО)2 - ацетат кальция, которая разлагается при нагревании и дает ацетон и снова карбонат кальция:
Са(СН3СОО)2 → СаСО3 + (СН3)2СО
Однако во многих реакциях не так просто обнаружить промежуточные продукты и приходится применять для этого комбинации различных методов.
Причина, по которой промежуточные продукты и, следовательно, промежуточные реакции могут стать фактором ускорения реакции, заключается в том, что для химической реакции важно не только столкновение реагирующих молекул, но и та энергия, которой они обладают (см. Кинетика химическая. Энергия активации). Медленность многих реакций обусловлена тем, что энергия активации слишком велика. Катализатор ведет реакцию по другому пути, на котором возникают промежуточные продукты, и, если это приводит к снижению энергии активации, реакция пойдет быстрее.
Катализаторы позволяют проводить реакции в более выгодных для производства условиях. Так, для большего выхода аммиака лучше проводить реакцию между азотом и водородом при возможно более низких температурах. Но при низких температурах азот и водород соединяются так медленно, что производство аммиака становится неэффективным. Катализатор, ускоряя процесс соединения газов, в то же время позволяет вести химический синтез аммиака при меньшем нагревании, чем потребовалось бы без катализатора. На процессах катализа основаны многие важные химические производства, такие, как получение серной кислоты, аммиака, азотной кислоты, синтетического каучука и ряда полимеров, синтез лекарственных препаратов, многих других необходимых для различных областей человеческой деятельности веществ.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'