
Кинетика химическая
Область химической науки, изучающая скорости химических реакций и особенности их протекания, ход химического превращения. При промышленном производстве различных химических продуктов очень важно знать закономерности протекания реакций во времени, т.е. зависимость их скорости и выхода продуктов от температуры, давления, концентрации реагентов и примесей. Но изучение кинетики реакций нужно не только для того, чтобы наилучшим образом организовать технологический процесс. Оно имеет большое значение и для построения общей теории реакционной способности.
Число известных в природе и технике химических процессов очень велико. Одни из них, например окисление бронзы на воздухе, протекают веками, другие - горение органических веществ - довольно быстро. А вот разложение взрывчатых веществ происходит за миллионные доли секунды. При всем разнообразии химических процессов, а к ним следует отнести и протекающие в живых организмах, в их основе лежат перемещения электронов во внешних "валентных" электронных оболочках атомов. Число различных видов частиц, определяющих принципиальные особенности различных химических реакций, невелико. Это молекулы, атомы, ионы, свободные радикалы и др. Общие теоретические основы химической кинетики базируются на свойствах этих частиц.
Фундамент химической кинетики был заложен примерно 100 лет назад, в 80-х гг. XIX в. голландским физико-химиком Я. Вант-Гоф-фом и шведским ученым С. Аррениусом, открывшими закономерности, связывающие скорости реакций с концентрацией реагентов и температурой. Эти закономерности получили сначала объяснения с помощью молекулярно-кинетической теории газов, а после разработки квантовой механики и статистической физики в 20-е гг. нашего века - с учетом этих физических теорий.
Основополагающими для химической кинетики являются представления о том, что исходные вещества, вступающие в химическую реакцию, чрезвычайно редко непосредственно превращаются в ее продукты. В большинстве случаев реакция проходит ряд последовательных и параллельных стадий, на которых образуются и расходуются промежуточные вещества. Число последовательных стадий может быть очень велико: в цепных реакциях их десятки и сотни тысяч. Время жизни промежуточных веществ весьма разнообразно. Некоторые вполне стабильны, их даже можно выделить из реакционной среды. Это обычно молекулы или комплексы. Другие, например свободные радикалы, существуют доли секунды и практически не могут быть выделены.
По мере того как развивалась химическая кинетика и накапливались знания, в самостоятельные ее разделы выделилось изучение отдельных классов реакций. Так, методы исследования кинетических закономерностей реакций в газовой фазе существенно отличаются от методов, разработанных для реакций, проходящих в жидких конденсированных или твердых средах. Специфика каталитических реакций (см. Катализ) оказалась столь велика, что их изучение превратилось в самостоятельную проблему. Кинетика реакций образования и разрушения полимеров также отдельная область науки. На основании данных о механизме и кинетических константах реакции (т. е. значений скорости реакции, величины энергии активации и др.) стало возможно предсказывать структуру образующихся макромолекул. Важную роль химическая кинетика играет при изучении процессов горения и взрыва, скорость протекания которых очень велика. С 40-х гг. XX в. методы химической кинетики начали использоваться и в биологии, что привело, в частности, к созданию научных основ получения лекарственных препаратов.
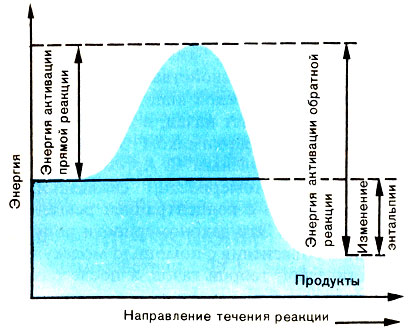
На рисунке к этой статье схематически показано изменение энергии, сопровождающее любую химическую реакцию. Для того чтобы при столкновении реагирующих частиц произошло химическое взаимодействие, они должны пройти промежуточное состояние, характеризующееся максимумом потенциальной энергии за время всего пути реакции. Оно получило название переходного состояния, или активированного комплекса.
Для образования активированного комплекса молекулы исходных реагентов должны обладать энергией активации. Из схемы видно, что для обратной реакции (см. Обратимые реакции) молекулы продукта накапливают энергию активации обратной реакции. Разность энергий активации обратной и прямой реакций равна изменению энтальпий исходных реагентов и продуктов (см. Термодинамика химическая).
До настоящего времени кинетические расчеты делают на основе экспериментально найденных значений кинетических констант. Однако принципиально возможно произвести такие расчеты, исходя непосредственно из свойств реагирующих молекул. Этим занимается раздел химической кинетики, носящий название теории абсолютных скоростей реакции.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'