
Металлотермия
Металлотермия - восстановление металлов из их соединений (оксидов и т. д.) более активными металлами: алюминием, кальцием, магнием и др. Металлотермические процессы протекают при повышенных температурах, с выделением теплоты. Впервые их изучил и подробно описал русский физико-химик Н. Н. Бекетов в 1865 г. А начало применения металлотермии в промышленных масштабах относится к рубежу XIX-XX вв.
Металлотермические способы производства металлов более дороги, чем обычная углевосстановительная металлургия (карботермия). Поэтому они используются для получения лишь тех металлов и сплавов, восстановление которых углеродом или невозможно, или приводит к недопустимому загрязнению продукта углеродом и карбидами (соединениями углерода с металлами). Методами металлотермии получают титан в виде губки, другие чистые металлы, некоторые сплавы, например безуглеродистый феррохром.
Выбор металла - восстановителя определяется многими условиями. Необходимо, чтобы он не образовывал с восстанавливаемым металлом сплавов и соединений, а избыток восстановителя и шлак легко отделялись от восстанавливаемого металла. Иначе чистого металла не получится. Кроме того, стоимость полученного продукта должна оправдывать расходы на восстановитель, особенно в случаях многотоннажного производства.
Из восстановителей, применяемых в металлургических процессах, кальций -самый активный. Кальцийтермическое восстановление химически прочных оксидов ТiO2, ZrO2, ThO2 наиболее полно протекает при 1000-1100°С. При этих температурах кальций интенсивно испаряется, поэтому восстановление производят в герметически закрытых стальных реакторах, заполненных аргоном.
Выбор соединения, из которого лучше восстанавливать металл, также очень важен. Дело в том, что оксиды некоторых металлов, например ТiO2, легко восстанавливаются только до низших оксидов (TiO), а не до свободного металла. Поэтому, в частности, титан чаще всего восстанавливают магнием из хлоридов - солей хлорводородной, или соляной, кислоты HCl
Существует несколько разновидностей металлотермических процессов. Внепечным процессом пользуются, если теплоты, выделяющейся во время реакции, достаточно для получения продуктов в жидком состоянии и удовлетворительного их разделения (а для этого нужны температуры 1750-2300°С). Пример такого процесса-алюминотермия. При внепечных алюминотермических процессах развивается температура до 3000°С. При очень большом тепловом эффекте реакция иногда протекает настолько бурно, что интенсивное выделение газов может выбросить часть шихты из реактора или даже разрушить его. В таких случаях в шихту вводят специальные добавки или применяют комплексные восстановители, обладающие меньшей активностью (например, сплавы Al-Si вместо чистого А1). Если же тепловой эффект реакции недостаточен и его надо увеличить, в шихту вводят так называемые подогревающие добавки, например CaSO4, КСlO3, и другие реагенты с высоким содержанием кислорода или оксиды с меньшей теплотой образования, чем оксид восстанавливаемого металла.
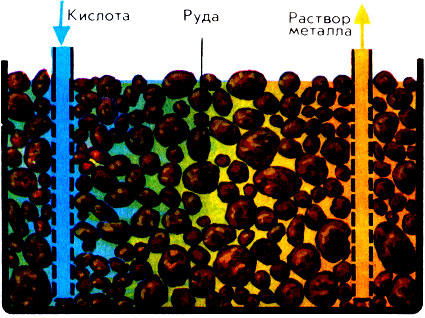
Выщелачивание металлов из руд с помощью серной кислоты - один из основных процессов гидрометаллургии
В случаях, когда тепловой эффект металлотермической реакции не обеспечивает достижения достаточной температуры, процесс проводят в электропечи. Тогда его называют печным, или электропечным.
Третья разновидность металлотермии - вакуумная - используется для выделения легкоиспаряющихся (летучих) металлов под вакуумом при температурах 800-1400°С. Так, например, получают магний и некоторые его сплавы. При этом используют оксид магния MgO, а в качестве восстановителей - А1, Si, сплавы Al-Si, СаС2. Проведение металлотермического восстановления в вакууме позволяет, кроме того, получать металлы, свободные от газообразных включений.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'