
Номенклатура химическая
В одном из средневековых алхимических трактатов можно прочитать такое описание химического опыта: "...С запада продвигайся сквозь сумерки на север; преврати воду в черную землю; поднимись через разные цвета к востоку, где показывается полная луна..." Подобные красочные, но, увы, непонятные строки часто встречаются в рукописях алхимиков. Это и не удивительно: можно ли выдавать непосвященным способы получения золота или эликсира, обещающего вечную молодость!
Превращение химии в науку требовало прежде всего создания общепонятной терминологии и важнейшей ее составной части - номенклатуры, т.е. системы названий химических соединений. Важные шаги в этом направлении сделал А. Лавуазье в конце XVIII в. Для того чтобы химики разных стран понимали друг друга, номенклатура должна быть единой. Об этом в настоящее время заботятся комиссии Международного союза чистой и прикладной химии (ИЮПАК).

Алхимики занимались в сущности очень простыми вещами, но изображали и описывали их в высшей степени сложно. Они не всегда умели отличить химический элемент от соединения, а некоторые из причудливых алхимических фигур обозначали! вообще не вещества, а процессы. Среди алхимических знаков были фигуры льва, дракона, символы планет и т.д. С развитием химии на научной основе появилась потребность в общедоступном научном языке. Различные системы знаков сменились буквенными обозначениями. Первую систему научных названий в химии выработала в 1787 г. Комиссия химиков во главе с А. Лавуазье. Современные символы элементов были предложены в первой половине XIX в. шведским химиком Й. Берцелиусом
Наиболее наглядное средство обозначения химического соединения - формула. Однако в устной речи, в связном тексте формулы употреблять неудобно; их заменяют названиями. Научные названия строятся по определенным правилам, позволяющим перейти от них к формуле.
Названия неорганических соединений составляются из названий образующих их химических элементов.
Элементарные (простые) вещества называются, как правило, так же, как и соответствующие элементы.
Одноатомные катионы называют так же, как соответствующие элементы, и, если нужно, указывают величину заряда римской цифрой в скобках: например, Сu+ - медь (I) - ион, Сu2+ - медь (И) - ион. Названия одноатомных анионов образуют из корней латинских названий соответствующих элементов с суффиксом "-ид", например С1- - хлорид-ион, S2- с ульфид-ион. Названия типа "хлор-ион" неправильны. Суффикс "-ид" используют также для обозначения электроотрицательных групп: ОН - гидроксид, NH2 - амид, SH - гидросульфид.
При построении названий все неорганические соединения условно рассматриваются как состоящие из электроположительной и электроотрицательной частей. Названия, как правило, составляют из двух слов, первым из которых является обозначение электроотрицательной части, употребляемое в именительном падеже, вторым - название электроположительной части, которое ставится в родительном падеже, например: NaCl - хлорид натрия, Na2SO4 - сульфат натрия, MgO - оксид магния.
В систематических названиях различие между соединениями ионного и ковалентного характера обычно не отражается (см. Химическая связь). Однако если нужно особо подчеркнуть ковалентный характер соединения, допускается назвать его одним словом, в котором название электроотрицательной части через гласную "о" соединено с названием электроположительной части. Например: OF2 - фторокислород, НСl - хлороводород, NO - оксоазот.

Школьники знакомятся с языком химической науки
Если соединение состоит из двух неметаллических элементов, то к более электроотрицательному из них прибавляется суффикс "-ид", второй компонент ставится после этого в родительном падеже. Например: FC1-фторид хлора, CS2 - сульфид углерода. При этом руководствуются следующим рядом: Ge, Si, В, Sb, As, Р, С, Н, Те, Se, S, I, Br, CI, N, О, F.
В необходимых случаях число атомов элемента и отдельных групп, входящих в состав соединения, обозначается при помощи греческих числительных: моно, ди, три, тетра, пента, гекса и т.д.
В некоторых случаях в названии соединения указывается степень окисления (окислительное число) электроположительного элемента (римской цифрой в скобках сразу после его обозначения).
Соединения, в которых все атомы кислорода непосредственно связаны с атомами электроположительного элемента и не связаны друг с другом, называются оксидами. Если элемент образует несколько оксидов, то в их названиях греческими числительными указывается число атомов кислорода, приходящихся на один атом электроположительного элемента. Например: СО - оксид углерода, СO2 - диоксид углерода, SO3 - триоксид серы. Используются также названия оксидов с указанием степени окисления элемента римской цифрой в скобках сразу после его названия. Например, СО по этой системе - оксид углерода (II), СO2 - оксид углерода (IV), Fe2O3 - оксид железа (III), SnCl4 - хлорид олова (IV), или тетрахлорид олова.
Названия кислородсодержащих кислот, сложные анионы которых имеют в качестве лигандов только атомы кислорода, составляются из прилагательного, образуемого из корня названия центрального элемента с суффиксом, характеризующим степень его окисления, и слова "кислота". Максимальной степени окисления центрального элемента отвечают суффиксы "-ная" или "-овая"; по мере понижения степени окисления суффиксы меняются в порядке "-оватая", "-истая", "-оватистая". Например, НСlO4 - хлорная кислота, НСlO3 - хлорноватая кислота, НСlO2 - хлористая кислота, НСlO - хлорноватистая кислота.
Названия солей кислородных кислот составляют из двух слов: названия аниона в именительном падеже и катиона в родительном. Названия анионов составляются из корней названий элементов с приставками и суффиксами, соответствующими степени окисления (по нисходящей степени): "-ат", "гипо-...-ат", "-ит", "ГИПО-...-ИТ". Например, KNO3 - нитрат калия, NaNO2 - нитрит натрия, LiClO2 - хлорит лития, NaClO - гипохлорит натрия. Число анионов и катионов в названиях солей, как правило, не указывается. Если же металл проявляет различные степени окисления, то она указывается в скобках римской цифрой. Например: FeSO4 - сульфат железа (II), Fe2(SO4)3 - сульфат железа (III). Названия кислых солей многоосновных кислот образуются добавлением к обозначению аниона приставки "гидро-", например KHSO4 - гидросульфат калия.
Названия комплексных анионов складываются из корня, приставок и суффикса "-ат". Корнем слова является корень латинского названия центрального элемента, перед которым в случае необходимости ставится степень его окисления (римская цифра в скобках). Приставки указывают природу лигандов и их число: AlFg-36 - гексафторо (III) алюминат.
Рассмотренные выше названия отвечают международным правилам ИЮПАК. Наряду с ними достаточно широко используются в литературе и русские названия: вместо "оксид" говорят "окись" (или иногда также "закись" для окислов низших степеней окисления), для солей названия строят из прилагательного, отвечающего природе аниона, и существительного, обозначающего катион. Например: Cu2O - закись меди, СuО - окись меди, NaCl - хлористый натрий, K2SO4 - сернокислый калий.
Достаточно широко распространены и так называемые тривиальные (несистематические, случайные) названия: Na2CO3 - coдa, КОН - едкое кали (но ни в коем случае не "едкий калий"), К2СО3 - поташ. Такие названия при частом употреблении удобнее длинных систематических названий, однако природы веществ они не отражают. В номенклатуре органических соединений приходится решать задачу более сложную, чем в номенклатуре неорганических соединений: здесь недостаточно указать состав вещества, надо в названии отразить и его строение, чтобы отличить от других, изомерных органических веществ (см. Изомерия). Эту задачу химики-органики решают, используя сложные слова-названия, построенные из обозначений отдельных составных частей и цифр или букв, указывающих порядок взаимосвязи отдельных частей молекулы. Используются два основных подхода к составлению названий.
По рациональной (или так называемой радикало-функциональной) номенклатуре основой названия служит простой представитель гомологического ряда с указанием усложняющих заместителей. Например:
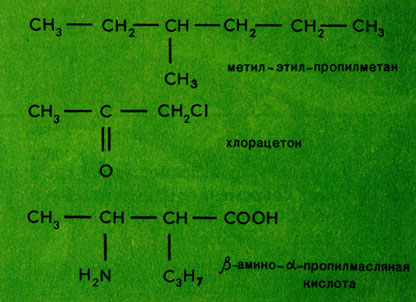
Последний пример показывает, что основой рационального названия может служить не обязательно первый представитель гомологического ряда.
Для построения заместительного названия по современным правилам ИЮПАК (существенно отличным от Женевских правил 1892 г., в которых были заложены основы заместительной номенклатуры) прежде всего находят главную функцию и главную цепь, которые вместе образуют родоначальную структуру; все остальные части молекулы рассматриваются как заместители в родоначальной структуре. При определении главной функции руководствуются приводимой ниже таблицей, в которой функции перечислены в порядке падающего старшинства. Главная цепь выбирается так, чтобы к ней примыкали главная функция и максимально возможное число других имеющихся функций (заместителей). Обозначение главной функции помещают в суффиксной части названия, обозначения всех иных имеющихся функций (заместителей) - в приставке, в алфавитном порядке. Для указания положения заместителей главную цепь нумеруют так, чтобы главная функция получила наименьший из возможных номеров. Между главной цепью и главной функцией в названии указывают характер насыщенности соединения ("-ан" - для насыщенных соединений, "-ен" - для двойной углерод-углеродной связи, "-ин" - для тройной углерод-углеродной связи). Обобщая сказанное, можно составить следующую общую схему заместительного названия:

Так, например, приведенное выше соединение III имеет современное заместительное название - З-амино-2-пропилбутановая кислота. Более сложный пример:
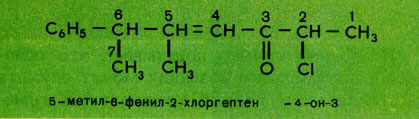
Свои, более сложные правила существуют для циклических соединений. Подробнее с ними можно ознакомиться в книге Дж. Бенкса "Названия органических соединений" (М.: Химия, 1980. 302 с).
В таблице, которая приводится ниже, собраны обозначения функциональных групп, используемые при составлении заместительных названий. Обратите внимание на то, что одна и та же функция может быть обозначена по-разному, в зависимости от того, является она главной (стоит в конце названия) или дополнительной (т. е. играет роль заместителя и стоит в начале названия), а также от того, считается ее С-атом входящим в главную цепь или нет (в таблице входящий в главную цепь С-атом взят в скобки).
Функциональные группы и их обозначения

Современная химическая номенклатура разработана международными комиссиями, стремившимися выразить в терминах всю информацию, содержащуюся в химических формулах.
jac n90 характеристики технические
|
ПОИСК:
|
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'