
Основания
Часто основаниями называют металлсодержащие химические соединения, в которых каждый атом металла связан с одной или несколькими гидроксогруппами, например NaOH, Са(ОН)2 и т.п. Однако класс оснований не ограничивается гидроксидами металлов. Понятие "основание" более сложное, оно возникает из рассмотрения кислотно-основных химических равновесий. В реакциях:
ОН- + H2SO4 ↔ HSO-4 + Н2О
СН3СООН + NH3 ↔ СН3СОО- + NH+4
серная и уксусная кислоты взаимодействуют с основаниями, отдавая им протон Н+. Вещества (а точнее, частицы, например анион ОН-), стремящиеся принять протон, называются основаниями (классическое определение Дж. Бренстеда, 1923). Согласно такому определению, основные свойства вещества зависят от партнера - кислоты. Чем сильнее кислота, тем легче основание принимает протон (обратное определение также верно). Так, вода или уксусная кислота в присутствии сильных кислот ведут себя как основания:
H2SO4 + Н2O ↔ HSO-4 + Н3O+ (ион гидроксония)
H2SO4 + СН3СООН ↔ HSO-4 + СН3СООН+2
(равновесие в этих реакциях смещено вправо).
Итак, по Бренстеду, нет основания без кислоты, как нет и кислоты без основания. Сила основания в каком-либо растворителе измеряется константой основности (Кb), которая прямо пропорциональна константе равновесия (К) реакции переноса протона (протолитической реакции) между основанием и растворителем. Например, константа равновесия для раствора аммиака в воде:
NH3 + Н2O ↔ NH+4 + ОН-
выражается
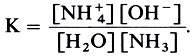
Поскольку в разбавленных растворах концентрация растворителя постоянна, то ее вводят в константу и получают выражение для константы основности:
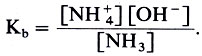
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'