
Простое вещество
Простое вещество - форма существования химического элемента в свободном виде. Подавляющее большинство элементов, содержащихся в природных объектах, выделены в виде простых веществ. Даже многие элементы, синтезированные с помощью ядерных реакций (технеций, прометий, нептуний, плутоний, америций, кюрий, берклий, калифорний), были получены в металлическом состоянии.
Ученые долгое время не могли провести четкого различия между элементами и простыми веществами. Это различие впервые с полной определенностью установил Д. И. Менделеев, указавший, что "простые тела суть вещества, содержащие только один какой-нибудь элемент...", и периодическая система относится именно к элементам, а не к простым веществам.
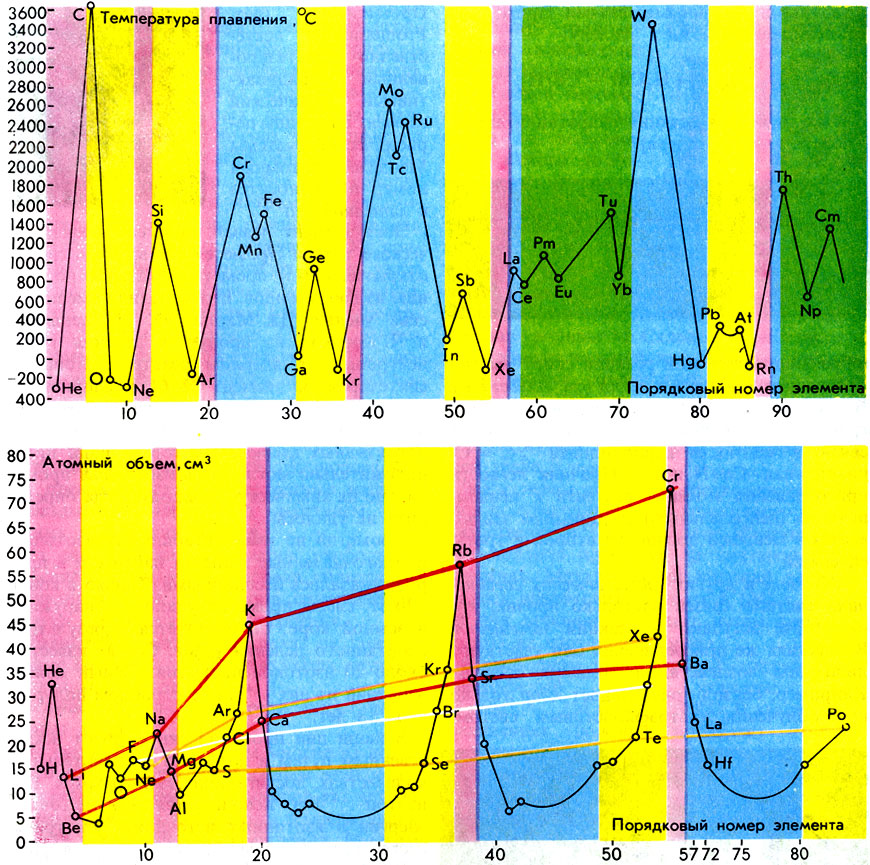
Таблицы атомных объемов (вверху) и температур плавления простых веществ
Число простых веществ значительно превышает число известных химических элементов. Многие элементы образуют несколько простых веществ, называемых аллотропическими модификациями (см. Аллотропия). Например, углерод в свободном виде существует в трех модификациях - алмаза, графита, карбина.
При обычных условиях большинство простых веществ - твердые тела. Водород, гелий, азот, кислород (и его аллотропическая модификация - озон), фтор, неон, хлор, аргон, криптон, ксенон и радон -газы. И только два элемента - бром и ртуть -при обычных условиях существуют в виде жидких простых веществ.
Подразделение простых веществ на металлы и неметаллы (или металлоиды) основано на специфике их физических и химических свойств. Металлов значительно больше. С точки зрения электронных конфигураций атомов к металлическим элементам относятся все те, в атомах которых заполняются электронами s-, d- или f-подоболочки. (Исключение составляют лишь водород и гелий.) К металлам относятся также некоторые р-элементы (алюминий, галлий, индий, таллий, олово, свинец, висмут, полоний), все прочие р-элементы - неметаллы.
С химической точки зрения четкую границу между металлами и неметаллами провести нельзя, поскольку есть несколько металлов, соединения которых обладают резко выраженными амфотерными свойствами, т.е. свойствами и металлов, и неметаллов (см. Амфотерность). Физики считают металлами вещества, отличающиеся хорошей тепло- и электропроводностью, характерным металлическим блеском (хотя такие свойства присущи и некоторым неметаллам). При очень высоком давлении все неметаллы, по-видимому, могут быть переведены в металлическое состояние. Так, удалось получить даже металлические водород и ксенон.
То, что называют физическими свойствами элементов, в значительной степени - свойства соответствующих простых веществ, и эти свойства очень разнообразны, в особенности для металлов. Если говорить о плотности, то самым легким металлом является литий (0,53 г/см3), а самым тяжелым - осмий (22,5 г/см3). Наиболее легкоплавка ртуть (-38,89°С), труднее всего расплавить вольфрам (3410 ± 20°С).
Наинизшая температура кипения характерна для ртути (357,25°С), а наивысшая - для рения (5900°С).
Свойства простых веществ находятся в зависимости от порядковых номеров элементов в периодической системе. Однако эта зависимость достаточно сложна и далеко не всегда линейна. Для примера рассмотрим зависимость температур плавления простых веществ от атомного номера (заряда ядра Z). Элемент, которым начинается каждый период системы элементов, является простым веществом с низкой температурой плавления (щелочные металлы). По мере роста Z температура плавления растет, проходит через один или несколько максимумов и достигает минимума в конце периодов (инертные газы). В малых периодах (второй и третий) высшие точки плавления приходятся на углерод и кремний (элементы IVa-подгруппы), в больших (четвертый-шестой) - на хром, молибден и вольфрам (элементы VIb-подгруппы). Таким образом, кривая температур плавления простых веществ также обнаруживает периодический характер (см. ил. на с. 224).
Хорошей иллюстрацией периодической зависимости свойств простых веществ от атомного номера служит кривая атомных объемов (атомный объем - частное от деления атомной массы на плотность), показанная на рисунке. Максимальные значения атомных объемов - у щелочных металлов, тогда как минимумы приходятся на элементы, располагающиеся в середине периодов. Кривая атомных объемов впервые предложена немецким ученым Л. Мейером в 1870 г.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'