
Радикалы свободные
Обычно молекулу можно расчленить двояко: либо так, чтобы пара электронов, образовавшая связь, осталась у одного осколка (тогда мы получим два иона), либо так, чтобы электронная пара поделилась между осколками. Такие осколки, частицы, обладающие свободными валентностями, т.е. имеющие неспаренные электроны на внешних орбиталях, называются свободными радикалами. Большинство из них нестабильны (неустойчивы) и могут существовать лишь доли секунды. Эти радикалы "живут" так недолго потому, что они очень реакционноспособны. Они могут вновь объединяться - это рекомбинация. Один может оторвать у другого, например, атом водорода - это называется диспропорционированием. Но чаще всего свободные радикалы присоединяются к другим молекулам.
Если молекула имела четное число электронов, то после присоединения к ней свободного радикала образуется новый радикал, который будет реагировать дальше и дальше. Такие реакции называются цепными. Они протекают с участием активных центров-атомов, ионов или свободных радикалов, обладающих неспаренными электронами и поэтому проявляющих большую реакционную активность. Свободные радикалы обозначают, ставя точки у тех атомов, где имеется неспаренный электрон. Роль активных центров могут играть атомы Н·, 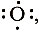 группы атомов ·ОН и др.
группы атомов ·ОН и др.
К разветвленным цепным реакциям относится образование воды из смеси водорода с кислородом при нагревании или пропуска-
нии электрического заряда. Молекулы этих газов взаимодействуют с образованием двух гидроксильных радикалов:
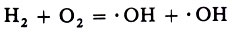
Радикалы ·ОН реагируют с молекулой водорода:
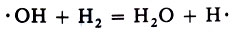
Свободный атом водорода Н· вступает в реакцию с молекулой O2, давая уже две новые активные частицы:
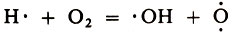
Атом кислорода, реагируя с молекулой Н2, также порождает два новых активных центра:
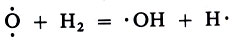
Так увеличивается число активных частиц и возрастает скорость цепной реакции.
Характерный пример цепных реакций -полимеризация. Свободные радикалы обычно участвуют также в реакциях пиролиза, горения, взрыва.
Кроме высокоактивных существуют и стабильные (устойчивые) свободные радикалы. Первый из них был получен американским химиком М. Гомбергом в 1900 г.:
(С6Н5)3С - Br + Ag → (С6Н5)3C· + AgBr
В середине XX в. были найдены и другие стабильные радикалы - феноксильные, имино-ксильные, гидразильные и пр. Формулы их сложны, а свойства удивительны. Свободные радикалы и их соли оказались активными катализаторами химических реакций, некоторые из них обладают полупроводниковыми свойствами, другие могут защищать полимеры от старения. И все они служат отличными объектами для изучения тонкостей строения вещества и химических реакций.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'