
Сера

Сера (лат. Sulfur) -химический элемент VI группы периодической системы Менделеева; атомный номер 16, атомная масса 32,06
С серой человечество знакомо с глубокой древности. Серу и продукт ее горения оксид (IV) SO2 издавна употребляли для отбеливания тканей и изготовления лекарственных средств, чернения оружия и приготовления черного пороха. В странах древнейших цивилизаций самородная сера была достаточно распространена; сицилийские месторождения этого горючего, с резким запахом желтого минерала разрабатывались еще древними римлянами. Русское название серы происходит от древнеиндусского "сира", означавшего светло-желтый. Но не всегда сера - светло-желтая. Цвет ее зависит от того, в какой из аллотропических модификаций находится сера (наиболее известны ромбическая и моноклинная сера), а также от температуры. Погруженная в жидкий воздух сера становится почти белой (см. Аллотропия).
В вулканических газах обнаруживают сероводород H2S и диоксид серы SO2
Сера принадлежит к числу довольно распространенных на нашей планете химических элементов, составляя примерно 4,7 · 10-2% от общей массы земной коры. Встречается самородная сера, но большая часть ее запасов находится в виде соединений-сульфидов и сульфатов. Основные из них - пирит FeS2, цинковая обманка ZnS, медный колчедан FeCuS2, гипс CaSO4 · 2H2O. Полагают, что большая часть земной серы сосредоточена в виде сульфидов (солей сероводородной кислоты H2S) не в земной коре, а на глубине 1200-3000 км. Добывают самородную серу из месторождений, залегающих на небольшой глубине.
Давно известные методы добычи самородной серы - термические. Сера легкоплавка, она превращается в жидкость при температуре 112,8°С (в зависимости от скорости подвода тепла и от того, в какой аллотропической модификации находилась сера). Большинство минералов при таком нагреве остаются твердыми, и расплавленную серу легко удалить из содержащих ее горных пород. Серу получают также из оксида (IV) SO2, образующегося при обжиге сульфидных руд металлов.
Сера - неметалл, это элемент химически активный. Она реагирует, со многими металлами: при комнатной температуре со щелочными, щелочноземельными, медью, серебром, ртутью, а при нагревании - с железом, алюминием, свинцом, цинком. Лишь с золотом и платиной сера не взаимодействует. Этот элемент вступает в соединения и с неметаллами (кроме азота и иода), хотя и не так легко, как с металлами. Степень окисления серы в соединениях меняется от -2 (H2S) до + 6(SO3).
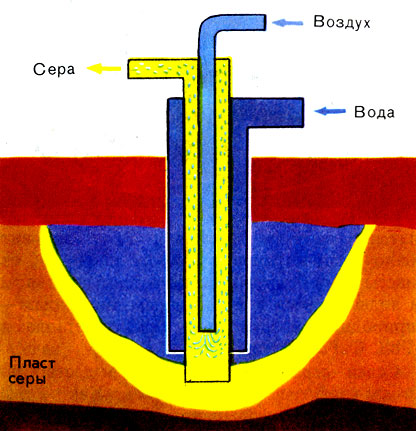
Добыча серы по методу Г. Фраша производится выплавлением ее из серных руд на месте их залегания перегретой водой через буровые скважины. В скважине помещают три трубопровода: для подачи перегретой воды (165-170°С), воздуха и транспортировки расплавленной серы на поверхность
Примерно половина добываемой в мире серы идет на производство серной кислоты Н2SO4 - главного, пожалуй, соединения серы, чрезвычайно важного для химической промышленности. Еще 25% расходуется на получение очень важного для производства бумаги гидросульфита кальция Ca(HSO3)2. Сера необходима для получения резины - вулканизированного каучука. Каучук смешивают с серой и нагревают. После вулканизации он становится прочным и эластичным.
Сера нужна также в производстве спичек и пластмасс, тканей и различных химикатов, лекарственных средств, например сульфамидных препаратов.
Серу следует считать жизненно важным элементом. Она входит в состав белков и аминокислот, ферментов и витаминов.
Из неорганических соединений серы кроме серной кислоты особенно важны оксиды серы SO2 и SO3, сероводород, H2S - ядовитый зловонный газ, используемый тем не менее и в химической промышленности, и как лечебное средство (сернистые ванны), а также сульфиды, сульфиты, сульфаты и тиосульфаты.
Соединения серы необходимы во многих отраслях промышленности и широко используются. Академик А. Е. Ферсман назвал серу "двигателем химической промышленности". Но нельзя не упомянуть и о том, что некоторые соединения этого элемента, и прежде всего газ SO2, сильно загрязняют атмосферу. Вредна сера и в составе углеводородных топлив, куда она переходит из нефти и газа. На нефтеперерабатывающих заводах существуют цехи очистки продуктов от серы - десульфуризации.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'