
Термодинамика химическая
Раздел физической химии, название которого происходит от греческих слов "терме" - "теплота" и "динамис" - "сила". Изучает он превращение теплоты, работы и других видов энергии, сопровождающих химические и физико-химические процессы. Химическая термодинамика как самостоятельная дисциплина сформировалась в конце XIX в.
В основе классической термодинамики лежат несколько положений, выведенных из опыта. Они сформулированы в виде четырех начал термодинамики, а из них математическим и логическим путем выводятся частные закономерности, позволяющие предсказать вероятное направление химических реакций и некоторые (термодинамические) свойства веществ. Эти свойства не зависят от пути реакции, от ее механизма, а определяются только начальным и конечным состоянием реагентов.
Механизмы химических реакций изучает другой раздел физической химии - кинетика химическая.
Основное понятие в термодинамике - система - некий объем, выделенный из окружающей среды. Системой может быть смесь реагентов в колбе, промышленном реакторе, кусок твердого вещества, капля жидкости, пузырек газа, живая клетка или целый организм. Закрытая система может обмениваться с внешней средой только энергией, а открытая - также и веществом. Термодинамическими свойствами системы считают массу (m), объем (v), давление (р), температуру (Т), плотность (рρ), концентрацию (С) и другие физические характеристики, а также специальные термодинамические функции: энтальпию, энтропию, свободную энергию, химический потенциал и т.д. Совокупность свойств определяет состояние системы. Вот простейшее уравнение состояния идеального газа: pv = nRT, где n-число молей, а R-универсальная газовая постоянная, равная
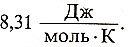
Кривые функциональных зависимостей термодинамических свойств, полученные при Т = const, называются изотермами, при р = = const-изобарами, а при v = - const-изохорами.
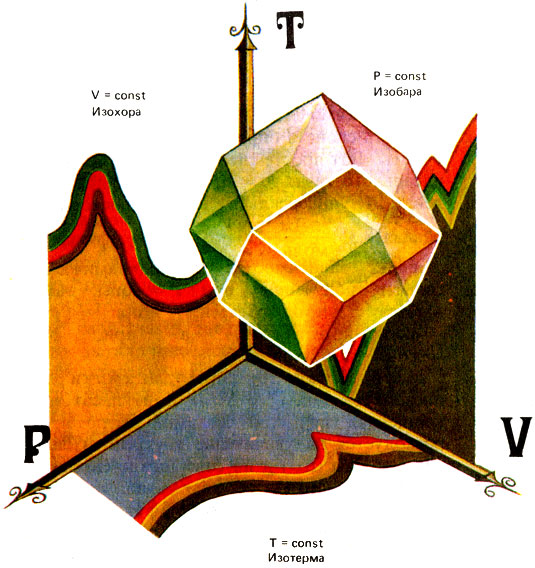
Как три координаты определяют положение тела в пространстве, так температура, объем и давление определяют состояние идеального газа
Первое начало термодинамики записывается так: Q = ΔU + А и гласит: поглощенная закрытой системой теплота (Q) расходуется на увеличение внутренней энергии системы (ΔU) и на совершение ею внешней работы (А). Из первого начала вытекает постоянство теплового эффекта реакции, если она проводится при v = const или р = const. При р = const тепловой эффект реакции равен изменению энтальпии (ΔН). Это термодинамическая функция: Н = U + pv.

В соответствии с первым началом термодинамики воздушный шар, поглотивший тепло, нагрелся и поднялся вверх вместе с пассажирами, т.е. совершил работу
Второе начало термодинамики было сформулировано в середине XIX в. на основании изучения действия тепловых машин. Одна из его формулировок такова: невозможно создать машину, которая посредством кругового процесса будет только переносить теплоту от более холодного к более нагретому телу. Следствием этого начала является введение в термодинамику новой физической величины -энтропии (S) - меры упорядоченности молекулярного движения, характеризующей тепловое состояние тела.

Согласно второму началу тер-модинамики невозможно создать вечный двигатель
Третье начало термодинамики сформулировал в 1906 г. немецкий физико-химик В. Нернст: энтропия системы при стремлении температуры к абсолютному нулю не зависит от ее параметров и постоянна. Вскоре немецкий физик М. Планк дополнил эту теорему предположением, что энтропия всех тел при температуре абсолютного нуля равна нулю. Это позволило рассчитывать абсолютные значения энтропии веществ.

Энтропия может быть равна нулю только при абсолютном нуле и только у идеального кристалла, но ни того ни другого в природе не существует
В 1931 г. Р. Фаулер ввел в термодинамику положение о термическом равновесии, которое иногда называют нулевым законом термодинамики: две системы, находящиеся в термическом равновесии с третьей системой, состоят в термическом равновесии друг с другом.
В термодинамических расчетах большое значение имеют термодинамические потенциалы, имеющие размерность энергии и получившие название свободных энергий: F = U - TS - изохорно-изотермический потенциал - энергия Гельмгольца, G = Н - TS - изобарно-изотермический потенциал - Гиббсова энергия, названные так в честь предложивших их ученых. Первая функция используется в расчетах процессов, протекающих при постоянном объеме, вторая - при постоянном давлении. Критериями самопроизвольного протекания процессов будут ΔF < 0 или ΔG > 0, а критерием равновесного процесса - ΔG = 0, если система не совершает полезной работы (см. Равновесие химическое).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'