
Термохимия
Термохимия как раздел физической химии изучает тепловые явления при химических реакциях и физико-химических процессах (испарении, плавлении, полиморфных превращениях, растворении). Под тепловым эффектом понимают теплоту процесса при двух условиях - постоянстве объема или давления и отсутствии других видов работы, кроме работы расширения; причем исходные вещества и продукты рассматриваются при одинаковой температуре. Его измеряют методами калориметрии. Величины тепловых эффектов выражают в килоджоулях на 1 моль исходно го или полученного вещества (кДж/моль) или в килокалориях на 1 моль (ккал/моль). Напомним, что 1 ккал = 4,1840 кДж.

Любой объект материального мира является термодинамической системой. Все, что изображено на этом рисунке: птица, вазочка с цветами и каждый цветок в отдельности, капля воды, свеча - все это подчиняется непреложным законам термодинамики. Песочные часы, стакан и книгу можно назвать закрытыми, все остальные предметы - открытыми системами. Они обмениваются массой с окружающей средой: вода испаряется, свеча сгорает, попугай дышит и питается. Первым объектом изучения термодинамики были тепловые машины
Изучаемые в термохимии процессы делятся на экзотермические (идущие с выделением теплоты) и эндотермические (протекающие с поглощением теплоты). Еще недавно в термохимических уравнениях записывали тепловой эффект экзотермических процессов со знаком "плюс", а эндотермических - со знаком "минус". Сейчас принято теплоту, выделившуюся при процессе, считать отрицательной, а поглощенную - положительной, поскольку тепловой эффект равен изменению величин, характеризующих тепловое состояние системы. Для изобарного процесса, идущего при постоянном давлении, такой величиной является энтальпия (теплосодержание) системы. Выделение теплоты при реакции отвечает уменьшению энтальпии, а поглощение теплоты - ее увеличению. Для изохорного процесса, идущего при постоянном объеме, такой величиной является внутренняя энергия; при выделении теплоты она убывает, при ее поглощении - возрастает.
Численные значения изменений энтальпии ΔН, внутренней энергии ΔU и некоторых других величин приводятся в таблицах термохи-мических данных (см. Термодинамика химическая). Все данные отнесены к температуре 25°С (298,15°К) и стандартным условиям - давлению 760 мм рт. ст. и наиболее устойчивым при этих давлении и температуре агрегатным состояниям участников реакции. Из термохимических данных наиболее важны для практики величины изменения энтальпии ΔH0298, тах как чаще всего приходится иметь дело с изобарическими процессами. Для отдельных видов ΔН применяются особые названия: теплота образования ΔHобр (тепловой эффект образования соединения из простых веществ), теплота сгорания ΔHсгор (тепловой эффект при полном сгорании вещества) и др.
Величины тепловых эффектов пишутся в правой части термохимических уравнений. Например, уравнение реакций образования жидкой воды из газообразных водорода и кислорода пишут так:
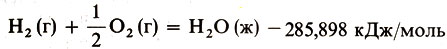
Образование ацетилена из графита (гр) и газообразного (г) водорода изображается уравнением:
2C(гр) + H2 (г) = С2H2 (г) + 226,78 кДж/моль
Тепловые эффекты процессов не всегда могут быть определены экспериментально. В таких случаях их вычисляют, пользуясь основным законом термохимии, открытым в 1840 г. русским химиком Г. И. Гессом: тепловой эффект процесса зависит только от начального и конечного состояния системы, но не от промежуточных стадий процесса. Как установили еще в 1780 г. французские ученые А. Лавуазье и П. Лаплас, теплота образования соединения равна теплоте его разложения. В свою очередь, законы Гесса и Лавуазье являются следствиями закона сохранения массы веществ и энергии.
Закон Гесса позволяет складывать и вычитать термохимические уравнения, т.е. поступать с ними так, как с обычными уравнениями в алгебре. Например, требуется определить тепловой эффект перехода графита (гр) в алмаз (алм). Осуществить этот процесс в калориметре невозможно. Однако на основании закона Гесса прямой переход графита в алмаз и тот же переход через промежуточную стадию - образование СO2 - должны сопровождаться одинаковым тепловым эффектом. Зная теплоты сгорания графита и алмаза, пишем уравнения:
С(гр) + O2 (г) = СO2 (г) - 393,608 кДж/моль
С(алм) + O2(г) = СO2 (г) - 395,504 кДж/моль
Вычтем второе уравнение из первого и получим тепловой эффект перехода графита в алмаз:
С(гр) = С(алм) + 1,896 кДж/моль
Теплоты образования (и другие термохимические данные) принадлежат к важнейшим физико-химическим константам и широко применяются как в исследовательских работах, так и в различных областях техники, в частности в химической технологии, металлургии, теплотехнике. Тепловой эффект сгорания топлива выражают в мегаджоулях (1 мДж = 106 Дж) на 1 кг твердого или жидкого топлива и на 1 м3 газообразного.
Приводим средние теплоты сгорания наиболее распространенных видов топлива:
Дрова-10,2 мДж/кг
Каменный уголь-28-34 мДж/кг
Мазут-39,2 мДж/кг
Бензин-44 мДж/кг
Природный газ-31-38 мДж/м3
Доменный газ-3,6-4,6 мДж/м3
Теплоты сгорания пищевых продуктов постоянно применяются для расчета рационов питания людей в зависимости от возраста и образа жизни. В таких расчетах принято выражать теплоту сгорания в килокалориях на 100 г продукта.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'