
Цепные реакции
Многие химические реакции - окисление органических веществ кислородом, хлорирование, бромирование водорода и других веществ, пиролиз, полимеризация - протекают по весьма своеобразному механизму. В начале реакции образуется небольшое количество активных атомов или свободных радикалов, которые быстро реагируют с молекулами исходных веществ. Но на каждой следующей стадии реакции снова образуются подобные же активные частицы, так что их концентрация все время остается более или менее постоянной. Получается, что одна активная частица способна вызвать целую цепочку последовательно протекающих повторяющихся реакций, общее число которых может достигнуть 106!
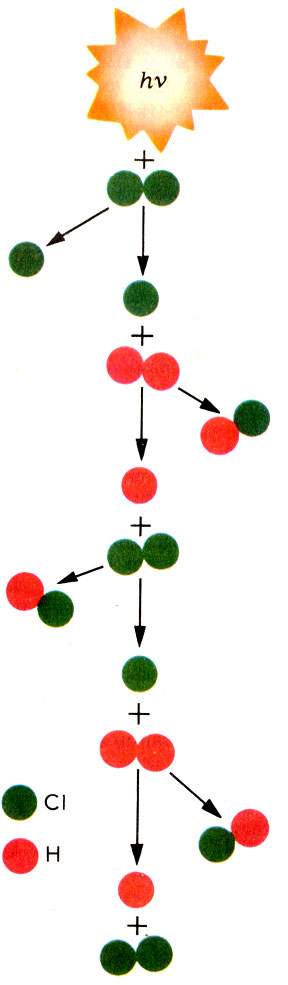
Реакция соединения хлора с водородом - одна из первых изученных цепных реакций
Впервые понятие о цепных реакциях было введено в науку в 1913 г. немецким ученым М. Боденштейном, изучавшим реакцию соединения хлора с водородом, протекающую при освещении реагентов. В темноте реакция не происходит. Ее уравнение можно записать так:
Н2 + Сl2 → 2НСl
Подобные реакции называют фотохимическими. Незадолго до работ М. Боденштейна немецкий физик А. Эйнштейн сформулировал основной закон фотохимии: молекула реагирующего вещества может стать активной, поглотив фотон - квант света.
Но почему один фотон, поглощенный молекулой хлора, может вызвать цепь реакций и почему скорость этой реакции непропорциональна концентрациям реагентов? Немецкий физико-химик В. Нернст в 1918 г. предположил, что молекула хлора, поглотив фотон, распадается на атомы. Атомарный хлор чрезвычайно активен. Он стремится вырвать атом водорода из молекулы:
Сl + Н2 → НСl + Н
При этом образуется также активный атомарный водород. Он будет атаковать молекулу хлора, отрывая от нее атом:
Н + Сl2 → НСl + Сl
И вновь образуется атомарный хлор.
Эти реакции будут чередоваться до тех пор, пока не исчерпаются реагенты или один из атомов не столкнется со стенкой сосуда, не адсорбируется на его поверхности (см. Сорбционные процессы).
Впоследствии было открыто много цепных реакций. В некоторых из них активными частицами были не атомы, а свободные радикалы. Свободные радикалы образуются при пиролизе многих органических соединений, когда разрываются ковалентные связи (см. Химическая связь). Например, при пиролизе этана образуются два метальных свободных радикала: С2Н6 → 2Н3С·. Точка в формуле обозначает неспаренный электрон.
В цепных радикальных реакциях различают стадии зарождения цепи, когда образуется активная частица (здесь свободные радикалы); развития цепи, когда последовательно протекают реакции превращения и образования свободных радикалов; обрыв цепи, когда свободные радикалы превращаются в неактивные молекулы, и реакция прекращается.
В некоторых цепных реакциях (окисление водорода, фосфора, серы, углеводородов и т.д.) на стадии развития цепи число свободных радикалов начинает возрастать, так как их образуется больше, чем расходуется. Такие реакции были открыты в конце 20-х гг. и получили название цепных разветвленных. Они могут начинаться медленно, но затем самоускоряться вплоть до протекания со взрывом. Наиболее изученная цепная разветвленная реакция - окисление водорода. Теорию таких реакций разработали в конце 20-х - начале 30-х гг. советский физико-химик Н. Н. Семенов и его английский коллега С. Хиншелвуд, за что они были удостоены в 1956 г. Нобелевской премии по химии.
В начале 40-х гг. советскими учеными Ю. Б. Харитоном и Я. Б. Зельдовичем на основании представлений о протекании цепных реакций был предложен правильный механизм цепной реакции деления урана, положенной впоследствии в основу ядерной энергетики.
Использование представлений о цепных разветвленных реакциях в значительной мере способствовало созданию теории горения и взрыва и большим практическим достижениям в этих областях.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'