
Элементы химические
Это понятие, пожалуй, одно из самых важных в естествознании. Ведь все многообразие окружающей нас природы состоит из сочетаний сравнительно небольшого числа химических элементов. В организме человека содержится около 70 элементов.
Нет точных сведений, откуда произошло слово "элемент". Согласно одной из версий, оно образовалось при последовательном произношении букв латинского алфавита-1, т, п, t. Прочтя их, вы получите "эль", "эм", "эн", "тэ". Древние мыслители якобы хотели подчеркнуть, что как слова состоят из букв, так и "тела" сложены из элементов.
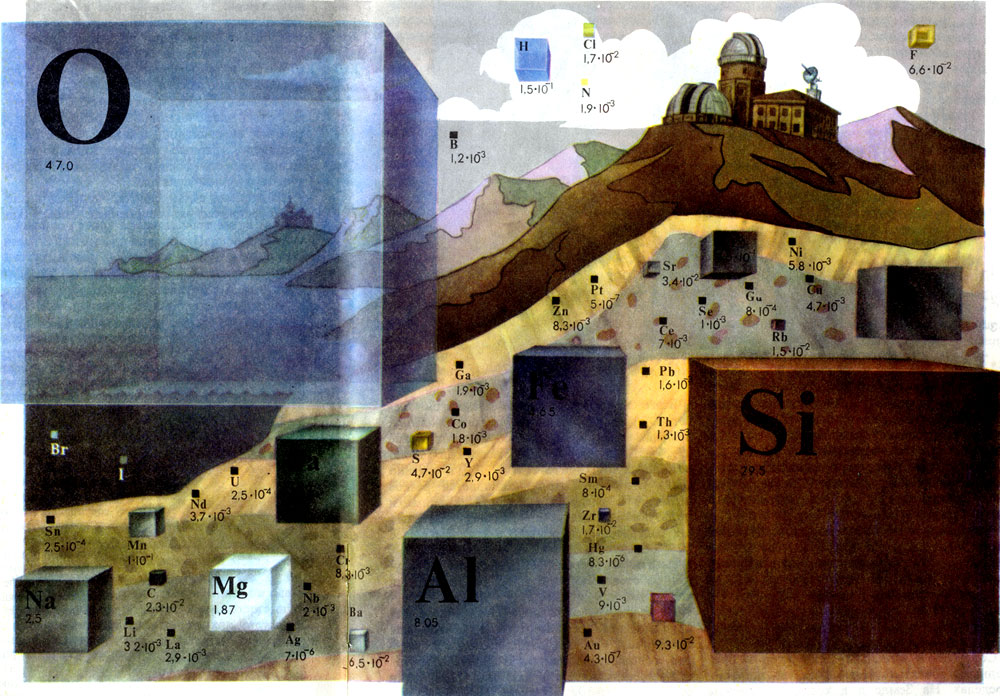
Схема распространения химических элементов
В различные исторические эпохи в понятие "элемент" вкладывался разный смысл. Древнегреческие философы в качестве "элементов" рассматривали четыре "стихии"-тепло, холод, сухость и влажность. Сочетаясь попарно, они образовывали четыре "начала" всех вещей-огонь, воздух, воду и землю. В средние века к этим началатм добавились соль, сера и ртуть. Долгое время царила неопределенность, пока в XVII в. Р. Бойль не высказал мысль, что все элементы носят материальный характер, а их число может быть достаточно велико и многие элементы еще предстоит открыть.
Элементами стали называть простые тела, которые не удавалось разложить химическими методами на еще более простые. В 1787 г. французский химик А. Лавуазье составил "Таблицу простых тел", в которую включил все известные к тому времени элементы, а также, как оказалось впоследствии, и некоторые сложные вещества.
В начале XIX в. английский ученый Дж. Дальтон приписал каждому элементу количественную характеристику - атомный вес (атомная масса). Элемент стали рассматривать как химическую индивидуальность. В 1871 г. Д. И. Менделеев четко разграничил понятия "простое тело" и "элемент" Он писал: "Простое тело есть вещество, металл или металлоид, с рядом физических признаков и химических реакций. Под именем элементов должно подразумевать те материальные части простых или сложных тел, которые придают им известную совокупность физических и химических свойств". Менделеев считал: углерод - элемент, а уголь, графит и алмаз - простые вещества. Для Д. И. Менделеева понятие "элемент" было отвлеченным. Оно получило конкретное определение с разработкой модели атома.
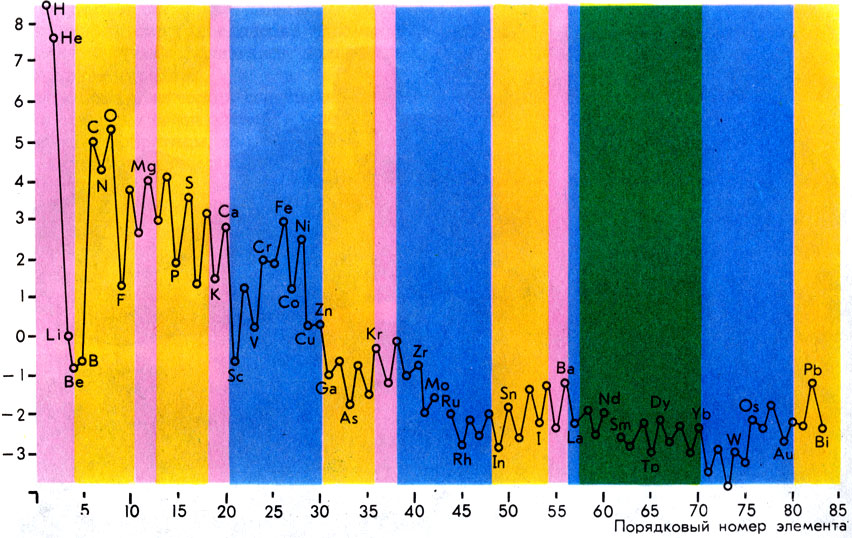
Логарифмы величин относительной распространенности химических элементов
Теперь понятие "химический элемент" определено точно, Это - совокупность атомов с одинаковыми зарядами ядер (Z) и одинаковым распределением электронов по оболочкам и подоболочкам (см. Атом). Для каждого элемента известны разновидности атомов, отличающиеся по массе (или, точнее, по числу нейтронов в ядрах). Эти разновидности называются изотопами.
Всего известно 107 элементов. Из них около 90 существуют в природе; остальные получены искусственно, с помощью ядерных реакций. Самый тяжелый элемент, обнаруженный в природе,- плутоний (Z = 94). Он является, таким образом, естественной верхней границей периодической системы химических элементов.
Содержание различных элементов в природных объектах колеблется в широких пределах. На Земле и в космосе элементы распространены по-разному. Сравните кривые содержания элементов, показанные на с. 350. Видно, что преобладающие элементы на нашей планете - кислород и кремний, тогда как в космосе господствуют водород и гелий. С чем связано такое резкое различие? На протяжении миллиардов лет Земля испытывала сложную химическую эволюцию. Значительная часть элементов, существующих в газообразном состоянии (водород, инертные газы), почти совсем улетучились из земной атмосферы. Однако заметна и общая закономерность: уменьшение содержания элементов по мере роста Z (заряда ядра атома) и на Земле, и в космосе.
Всего лишь 8 химических элементов - кислород, кремний, алюминий, железо, кальций, натрий, калий и магний -составляют более 99% земной коры по массе, на долю остальных приходится менее 1%, и именно среди этих элементов наблюдается резкое различие в распространенности. Геохимики пользуются понятием "редкие элементы" (их содержание составляет в среднем менее 10-4% массы этого 1%) и "рассеянные элементы", которые фактически не образуют собственных минералов, а содержатся как примеси к другим.
Исторически сложились такие названия определенных совокупностей элементов, как органогены (углерод, азот, кислород и водород - основные элементы, входящие в состав органических веществ), галогены, щелочные и щелочноземельные металлы, платиновые металлы, редкоземельные элементы, радиоактивные элементы.
Все химические элементы произошли в результате сложных космических процессов ядерного синтеза, задолго до того, как образовались Солнечная система и планета Земля. Элементы, имеющие стабильные или долго-живущие радиоактивные изотопы (торий и уран), вошли в состав Земли как первичные элементы. Естественные радиоактивные элементы, входящие в ряды радиоактивных превращений урана и тория, являются вторичными. Их периоды полураспада невелики, гораздо меньше возраста Земли, поэтому их первоначальные "ресурсы" давным-давно исчезли. Теперь они, так сказать, заново образуются на Земле - как продукты последовательных радиоактивных превращений урана и тория. Следовательно, содержащиеся на нашей планете химические элементы различаются по своему происхождению.
Форма существования химических элементов в свободном состоянии называется простым веществом. Некоторые химические элементы известны в виде двух или более простых веществ (см. Аллотропия), так называемых аллотропических модификаций. В настоящее время все обнаруженные на Земле элементы, а также некоторые трансурановые элементы получены в свободном состоянии. Инертные газы встречаются в природе исключительно в виде простых веществ, несколько элементов - в виде простых веществ и соединений, но большинство - только в форме соединений. Агрегатное состояние большинства простых веществ при нормальных условиях - твердое. Жидкости - лишь бром и ртуть. Водород, азот, кислород, фтор, хлор, гелий, неон, аргон, криптон, ксенон и радон газообразны.
По своим химическим свойствам элементы подразделяются на два больших класса: металлы и неметаллы. Из 107 элементов 85-металлы. Их характерная особенность - способность образовывать элементарные, положительно заряженные ионы при химических взаимодействиях и наличие свободных, не связанных с определенными атомами электронов. Однако граница между металлами и неметаллами довольно расплывчата.
Открытие существующих в природе элементов происходило в течение длительного времени. Хронологическая последовательность открытий химических элементов зависела, во-первых, от их специфических свойств, во-вторых, от разработки новых методов химического анализа.
В первую очередь человеку стали известны так называемые элементы древности (золото, серебро, ртуть, железо, медь, олово, свинец, сера, углерод), потому что они встречаются на Земле в свободном (самородном) состоянии или их легко получить из содержащих их минералов. Однако это не были открытия в полном смысле слова, так как датировать их невозможно. В средние века, в период господства алхимии, случайно были изучены мышьяк, сурьма, висмут, цинк и фосфор.
Массовое открытие новых элементов началось во второй половине XVIII в. Исследования по пневматической химии (изучение свойств газов) привели к открытию таких важных элементов, как водород, азот и кислород.
Многие элементы были открыты благодаря химико-аналитическому методу. С помощью его обнаружено около 30 новых элементов. Разработка электрохимического метода пополнила список элементов натрием, калием, магнием и кальцием. Методом спектрального анализа было доказано существование рубидия, цезия, индия и таллия.
К моменту открытия периодического закона (1869) было известно 63 элемента. Периодическая система позволила предсказывать свойства новых элементов и в значительной степени устранила момент случайности в их открытиях. Теперь каждый новый элемент должен был занять определенное место в таблице Менделеева. До физического обоснования периодического закона в границах системы между водородом и ураном были открыты почти все стабильные элементы (кроме гафния с Z = 72 и рения с Z = 75) и почти все радиоактивные элементы (кроме астата, Z = 85, франция Z = 87, технеция Z = 43 и прометия Z - 61).
Технеций, астат и прометий, а также 15 трансурановых элементов были получены искусственно, с помощью ядерных реакций.
Многие химические элементы (главным образом металлы) первоначально были выделены в форме соединений, а получены в свободном виде иногда много лет спустя. Это было связано с трудностями химического выделения этих элементов из соединений.
В наше время почти все химические элементы находят то или иное практическое применение. Некоторые элементы, считавшиеся ранее бесперспективными, теперь играют исключительно важную роль (например, бериллий, титан, цирконий, галлий, германий, тантал, рений) - как материалы новой техники.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'