
Энергия активации
Скорость подавляющего большинства химических реакций увеличивается при повышении температуры. В начале 80-х гг. XIX в. голландский физико-химик Я. Вант-Гофф показал, что скорость большинства химических реакций возрастает в 2-4 раза при повышении температуры на каждые 10°С.
В 1889 г. шведский ученый С. Аррениус, обобщив результаты, полученные к тому времени многими химиками, предложил уравнение зависимости константы скорости реакции (см. Кинетика химическая) от температуры:
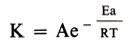
В нем К-константа скорости; А-постоянный коэффициент, характерный для каждой реакции (предэкспоненциальный множитель); R-газовая постоянная;. Т-температура по абсолютной шкале; Еа-величина, характерная для каждой реакции, названная Аррениусом энергией активации.
Аррениус предположил, что при столкновении реагируют не все молекулы, а лишь те из них, которые обладают необходимым количеством избыточной энергии по сравнению со средней энергией молекул при данной температуре. Она и называется энергией активации и измеряется в кДж/моль. Чем выше температура, тем большая часть молекул приобретает эту энергию и, следовательно, способность реагировать. Чем меньше величина Еа, тем больше молекул при данной температуре могут прореагировать, а при Еа = 0 каждое столкновение молекул будет приводить к реакции, скорость которой в этом случае была бы равна числу столкновений в единице объема за единицу времени.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'