
Металлорганические катализаторы
Этот вид катализаторов в настоящее время широко изучается. Теория механизма действия этих катализаторов чрезвычайно сложна и требует привлечения положений химии координационных соединений*, метода молекулярных орбит, ферментативного катализа и т. д. Единой теории, объединяющей все случаи действия металлорганических катализаторов, до сих пор нет. Но, видимо, основным фактором каталитической активности и специфичности действия металлорганических катализаторов является природа комплексообразующего металла (или, вернее, иона металла). Вторым фактором каталитической активности металлорганических катализаторов является природа органических молекул (ионов), входящих в состав катализатора (они часто называются аддендами или лигандами). И ион металла и адденд динамически взаимосвязаны между собой, и эта взаимосвязанность также является необходимой и важной деталью в картине каталитического действия металлорганического комплекса.
* (Координационные, или комплексные, соединения - такие химические соединения, в которых центральный атом или ион, обычно металла, окружен некоторым числом других ионов или органических молекул. Центральный атом или пои и окружающие его различные молекулы (лиганды) связаны химической связью и электростатическими силами.)
В настоящее время сравнительно четко определились три типа катализа металлорганическими соединениями. Первый гит металлорганического катализа определился в результате изучения и главным образом моделирования ферментативных реакций. Он наиболее тесно связан с реакционноспособностью комплексных координационных соединений, и каталитический эффект здесь обеспечивается в основном участием ионов переходных металлов. Второй тип металлорганического катализа характерен для катализаторов Циглера и им подобных. Применение этих катализаторов ознаменовало собой переворот в прикладном катализе. Протекание реакции в присутствии катализаторов Циглера связано с образованием промежуточных металлорганических комплексов и свободных радикалов. Третий тип металлорганического катализа - так называемый полихелатный катализ - получил широкое развитие только за последнее время. По своей природе он близок к первому типу металлорганического катализа. Отличительной чертой полихелатных катализаторов является своеобразная структура "каталитического узла" и способность к полимеризации.
Одним из металлорганических катализаторов первого типа является комплекс медь - биурет.
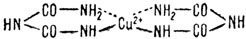
Этот комплекс является активной моделью фермента каталазы (в живом организме), который катализирует реакцию
2Н2О2 → О2 + 2Н2О.
Эта, очень важная в жизнедеятельности организма, реакция входит в общий окислительно-восстановительный цикл. Кроме того, в процессе этой реакции уничтожается перекись водорода - первоисточник свободных органических радикалов. Наличие же в организме свободных радикалов часто ведет к нарушению структуры клетки. Исследование каталитического действия комплекса медь - биурет (как и других катализаторов подобного типа) показало, что центральным явлением в механизме этого процесса является делокализация электронов- внутри системы металлорганический комплекс - субстрат. Атомные орбиты иона металла служат местом формирования молекулярных орбит промежуточного комплекса. Для выполнения каталитических функций металлорганическим комплексом (данный тип металлорганических катализаторов) необходимым условием является неизменность валентного состояния иона металла при взаимодействии его с лигандами. В этом случае ион-металла сохраняет возможность поляризовать молекулу субстрата, а связующие группы лигандов должны быть при этом нейтральными или положительными (если ион металла положителен). Связующие группы субстрата, наоборот, должны иметь отрицательный заряд для образования связи ион металла - субстрат. "Каталитические обязанности" целиком ложатся на ион металла, который в роли "стрелочника" переводит электрон с одной поляризованной группы субстрата на другую, что и приводит к изменению молекулярной структуры субстрата в целом. Механизм каталитического действия комплекса медь - биурет в реакции разложения перекиси водорода заключается в предварительном перераспределении электронов в электронной оболочке иона меди по соответствующим орбитам, затем в образовании промежуточного комплекса. Благодаря принятию электронов лигандов на освободившиеся в результате перераспределения электронов орбиты иона меди и активации этого промежуточного комплекса с некоторым уплотнением электронов на орбитах комплекса свободные места на этих орбитах занимают электроны субстрата. В результате взаимодействия Н2О2 с комплексом медь-биурет образуется, таким образом, комплекс биурет - Сu2+ - Н2О2 - очень нестабильный, в котором сравнительно легко идет перераспределение связей, с последующим распадом комплекса на катализатор и конечные продукты. Приблизительно так выглядит механизм каталитического действия металлорганических катализаторов первого типа.
Теперь о металлорганических катализаторах второго типа. В 1957 году работами Натта и Бреслау, а также работами Циглера было установлено, что процессу полимеризации этиленовых углеводородов чрезвычайно способствует совместное участие в реакции металлорганических соединений титана и алюминия. Была предложена гипотеза об образовании в этом процессе промежуточного комплекса.
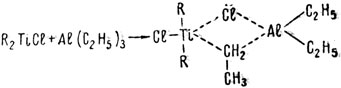
где R - органический радикал. Этот комплекс обладает каталитическими свойствами за счет делокализации электронов в нем и образования внутри него целого ряда нестабильных связей включая и связи с соответствующим мономером. Вот как упрощенно можно трактовать начальную стадию полимеризации этилена с помощью этого каталитического комплекса;
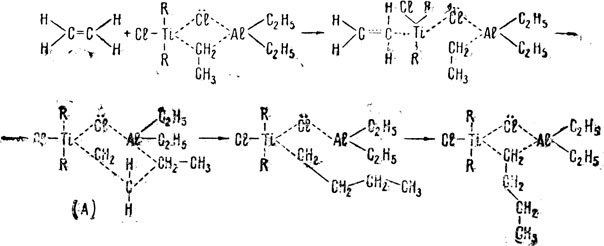
Здесь необходимы некоторые пояснения. Во-первых, пунктирные связи вовсе не обозначают, что титан здесь пятивалентен, алюминий четырехвалентен, а хлор двухвалентен. Все эти элементы имеют нормальную валентность соответственно 4, 3 и 1. Но с помощью пунктирных связей показано, что положения связующих электронов нельзя строго фиксировать. Данный каталитический комплекс представляет собой не застывшую схему распределения электронов и ядер атомов, а подвижную - динамическую-структуру. Изображенное выше начало процесса полимеризации, если вы внимательно в него всмотритесь, происходит за счет подвижности так называемой неполной связи Ti... С... А К Принимая молекулу этилена, комплекс раскрывается с разрывом связи Ti... С. Следующая стадия реакции состоит в образовании промежуточного циклического комплекса (А), поскольку его образование энергетически и геометрически выгодно - ведь каждый атом должен занять наиболее удобное положение в молекуле комплекса согласно их объемной структуре. Особенно выгодно образование шестичленного кольца. В состав комплексного цикла входят различные по своей природе атомы, кольцо оказывается непрочным и на следующей стадии происходит разрыв связи С...Аl. Молекула этилена как бы перемещается по комплексу. И, наконец, этот комплекс приобретает свой первоначальный вид, только внизу у него повисла молекула этилена. По мере продолжения процесса полимеризации ниточка из молекул этилена начинает расти и расти. И постепенно образуется полиэтилен. Причем видно, что здесь исключается возможность разветвления полимеризационной цепи. Это очень важное обстоятельство в современном производстве полимеров.
Последний тип металлорганических катализаторов - полихелатные катализаторы находят применение в процессах полимеризации, производстве биологически активных веществ и органических полупроводников. Полимерное строение и особая специфичность этих катализаторов потребовали новых подходов и методов для изучения их действия. Результаты по исследованию каталитической активности полихелатов, полученные академиком Г. К. Боресковым, указывают на большую каталитическую активность и высокую избирательность действия подобных катализаторов.
В объяснениях механизма действия металлорганических катализаторов имеется еще большое количество "белых пятен", скрывающих за собой те "могучие пружины", которые приводят в согласованное действие структуры металлорганических комплексов, например, в биологических системах. Термодинамическая сторона вопроса о механизме действия металлорганических катализаторов тоже изучена очень слабо. Каталитическое действие некоторых ферментных моделей, как было показано экспериментально, происходит целиком за счет изменения энтропийного фактора. В дальнейшем было замечено, что для катализа комплексами тоже характерно как раз изменение энтропийного фактора. Видимо, в процессе реакции имеет место возникновение весьма "рыхлого" переходного комплекса, системы с большой энтропией. Значит, активность комплекса в каталитическом смысле непосредственно связана с его лабильностью. Возрастание энтропии в переходном состоянии, т. е. "хаотизация" системы катализатор - субстрат и последующая регенерация структуры катализатора, возможно, составляют характерный признак каталитического действия комплексных соединений. Следует заметить, что ускорение реакции за счет энтропийного фактора менее специфично и требует выполнения менее сложных условий ее протекания. Энергетическая сторона действия металлорганических катализаторов так же, как и для ферментов, чрезвычайно важна. Здесь необходимо упомянуть о явлении аггравации в тонком катализе. Известно, что ион железа обладает окислительным действием. Ион железа в составе некоторых органических молекул (например, в очень важной в биологическом отношении молекуле порфирина) увеличивает интенсивность этого своего действия в сотни тысяч раз. Таким образом, усложнение комплекса (увеличение так называемых "балластных групп") ведет к повышению активности катализатора в целом. Сущность эффекта аггравации, таким образом, заключается в способности ионных и органических катализаторов повышать свою активность за счет, энергии дополнительных химических и межмолекулярных связей со сложными молекулярными аддендами. Явление аггравации лучше всего наблюдать при исследовании действия моделей ферментов. Эти модели, а также и сами ферменты обладают особой способностью - не рассеивать полученную в ходе реакции энергию электронного возбуждения (как часто это происходит в обычных молекулах), а относительно длительное время задерживать ее на своих связях (в особых "ловушках") или передавать по системе молекул, возбуждая их электроны. У органических молекул, способных создавать эффект аггравации, теплоемкость слабо зависит от строения, но закономерна растет со сложностью молекулы (вместе с этим растет в способность такой молекулы приобретать избыток энергии). Вероятнее всего, что именно эта неспецифичная, не зависящая от детального строения способность органических молекул и является физической основой эффекта аггравации в катализе. Захват энергии реакции агграватором ведет к тому, что в последующие стадии реакции фермент или модель фермента (в том числе и металлорганические катализаторы) вступает энергетически возбужденным. Дополнительная энергия позволяет в ходе каталитической реакции с большей легкостью преодолевать активационный барьер.
На этом можно закончить краткий обзор некоторых теоретических обоснований действия металлорганических катализаторов. Перспективы развития металлорганического катализа связаны с развитием химии комплексных соединений. Несомненно, что при этом большой интерес могут вызвать возможные каталитические свойства комплексов переходных металлов с органическими углеводородными системами или молекулярные комплексы с переносом заряда. Чувствительность к внешнему воздействию металлорганических комплексов (благодаря лабильности связей в этих молекулах) является одной из предпосылок наличия у них специфических каталитических свойств. Такой катализатор может представлять собой своеобразный π-комплекс - активное промежуточное соединение, для которого характерно наличие многоцентровых π - электронных связей. К такого рода катализаторам можно отнести и катализаторы "сэндвичевого" типа, в которых ион металла "зажат" между двумя плоскими ароматическими кольцами (бензола или его производных). Все эти катализаторы могут быть использованы в качестве моделей целых ферментативных систем в направленном органическом синтезе. Применение металлорганических катализаторов в качестве моделей ферментов и биологически активных природных веществ в настоящее время получило еще больший размах, чем применение органических катализаторов. Здесь прежде всего следует отметить синтез металлорганического катализатора - гемина. Гемин - металлорганический комплекс, состоящий из иона железа и органического вещества протопорфирина, входит в состав гемоглобина. Искусственно синтезированный гемин так же, как и его природный аналог, проявляет каталитическую активность в окислительно-восстановительных процессах. Насколько эффективно каталитическое действие гемина в реакции окисления, говорит следующий факт. Гемин в присутствии пиридина ускоряет самоокисление бензальдегида в 50 раз сильнее, чем обычные соли двухвалентного железа. С помощью другого металлорганического катализатора, в котором ион меди связан с салициловым альдегидом и Ο-аминофенолом, оказалось возможным моделировать действие фермента аскорбиноксидазы в реакции окисления аскорбиновой кислоты - витамина С. Действие фермента полифенолоксидазы можно воспроизвести с помощью каталитически активных комплексов меди с этилендиаминами или этаноламинами. Отдельные металлорганические катализаторы, представляющие собой сложные комплексы ионов кобальта, марганца, цинка с различными органическими веществами, в некоторых случаях по своему действию похожи на дыхательные ферменты или ферменты, регулирующие обмен веществ в организме.
* * *
Пытливая мысль исследователя давно ищет решения проблемы направленного органического синтеза при наименьших энергетических затратах. Непревзойденным образцом в этом отношении остаются химические процессы, протекающие в живом организме. Моделирование ферментативных процессов с помощью органических или металлорганических катализаторов - только первый шаг в переносе принципов химической деятельности живых организмов в область искусственного синтеза. Результаты, полученные при этом, в практическом и теоретическом отношении многообещающие. Широчайшие возможности в деле использования органических и металлорганических катализаторов откроются при создании искусственных, самоуправляющихся по принципу обратной связи каталитических систем. Для выполнения этой сложнейшей задачи потребуются дружные усилия химиков, физиков, математиков и физиологов.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'