
Трудный путь периодического закона
Блестяще оправдались предсказания Менделеева - открыты три новых элемента: галлий, скандий, германий. Разрешилась долго мучившая ученых загадка бериллия. Атомный вес его был наконец точно определен, и место элемента рядом с литием подтвердилось раз и навсегда. К 90-м годам XIX в., по словам Менделеева, "периодическая законность упрочилась". В учебники по химии в разных странах уже без сомнений стали включать менделеевскую периодическую систему.
Великое открытие получало всеобщее признание.
Но слишком много загадок, слишком много непонятного и неясного хранила в себе система элементов. Словно химический сфинкс задавала она ученым вопрос за вопросом, ответов на которые не было.
Сколько всего элементов должна содержать периодическая система? Существуют ли элементы легче водорода и тяжелее урана, элементы между водородом и литием? Почему все еще зияют пробелы, соответствующие некоторым предсказанным Менделеевым элементам? Или взять таинственную область редких земель, расположившуюся в середине таблицы: сколько их? Каждый год провозглашались открытия нескольких новых редкоземельных элементов, а спустя короткое время выяснялось, что исследователи попросту ошибались.
Видите, сколько вопросительных знаков ставила перед учеными периодическая система!
А ответов не было.
Не было потому, что оставалось неясным главное: в чем состоит глубокая физическая причина периодического изменения свойств элементов? Этого не знал никто. Существовали лишь смутные догадки, что свойства элементов могут быть связаны с устройством их атомов. Но как устроены атомы - этого также никто не знал.
Да и атомный вес - эта, казалось бы, незыблемая опора периодического закона - иногда давал осечку. Скажем, атомный вес теллура был больше атомного веса иода. Но по своей химической природе теллур должен был стоять перед иодом, иначе грубо нарушалась гармония системы. Такая же аномалия наблюдалась и в паре кобальт-никель. А почему это так - опять же объяснения отсутствовали.
Судьбы великих открытий порой бывают очень трудными. На их пути встречаются серьезные испытания, которые иногда даже ставят под сомнение истинность открытия.
Так было и с периодической системой элементов.
Великое испытание периодической системы.
26 октября 1868 г. на заседании Парижской академии наук были прочитаны одно за другим два письма. Одно было получено из Индии от французского астронома Ж. Жансена, другое - из Англии от английского астронома Н. Локьера. Оба сообщали, что в спектре солнечных протуберанцев они (независимо друг от друга) обнаружили желтую линию, которая не могла принадлежать ни одному химическому элементу из существующих на земном шаре. Было решено, что новая линия в спектре принадлежит какому-то особому "небесному" элементу. Он был назван древнегреческим именем Солнца - гелий.
Спустя 25 лет после открытия гелия на Солнце знаменитый английский физик Д. Рэлей обнаружил очень странный факт: плотность чистого азота, добытого из воздуха, больше плотности того же азота, полученного из любого азотного соединения. Разница была ничтожна - тысячные доли грамма на литр, но она была.
Рэлей написал об этом письмо в лондонский журнал "Природа". Он спрашивал, не сумеет ли кто-нибудь из читателей журнала объяснить, почему "воздушный" азот тяжелее. Но ответов не последовало. Тогда Рэлей обратился к своему другу - известному английскому химику В. Рамзаю, и они решили, что каждый из них не покинет свою лабораторию, пока загадка не будет разгадана.
Они работали разными методами и наконец нашли, что в обычном воздухе существует какая-то примесь, и не малая: в каждом литре воздуха содержится около 10 см3 еще не известного газа. Они дали ему имя аргон. Странный это был газ. Подобных веществ химики не знали. Никакими средствами не удавалось заставить его вступать в химические реакции. Это и было выражено в его названии: в переводе с греческого "аргон" значит ленивый.
Аргон оказался новым химическим элементом. Затем Рамзай узнал, что геолог и химик В. Гильдебрант наблюдал минералы (они содержали уран или торий), которые при нагревании выделяют какой-то негорючий газ. Рамзай решил проверить, не аргон ли это.
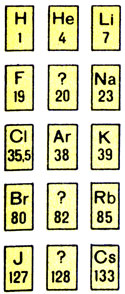
Так были предсказаны Рамзаем на основании периодической системы благородные газы. По существу, это было сделано совершенно так же, как Менделеев предсказал галлий, германий и скандий. Все пустые места вскоре заняли вновь открытые элементы: неон, криптон и ксенон. Атомные веса на карточках приближенные
Но газ, выделившийся из минерала клевеита, оказался не аргоном. У него был совершенно другой спектр, отличный от уже изученного спектра аргона. Рамзай дал ему имя "криптон" (тайный) и послал запаянную пробирку с "криптоном" одному из опытных спектроскопистов английскому химику и физику В. Круксу для точного исследования спектра.
В ответ он получил телеграмму: "Криптон - это гелий. Приходите и посмотрите. Крукс".
Так газ, впервые за четверть века до этого найденый на Солнце, был обнаружен на Земле. Гелий оказался самым легким газом после водорода.
Но периодический закон не предусматривал существования таких химических элементов, как гелий и аргон. Для них в периодической системе не было пустых клеток. Куда же поместить новые элементы? Скептики снова воспрянули духом, снова зазвучали голоса сомневающихся в периодической системе и периодическом законе. Но это продолжалось недолго.
В 1897 г. Рамзай прочел доклад, который он озаглавил так: "Еще не открытый газ". Рамзай сказал: "По образцу нашего учителя Менделеева я описал, поскольку возможно было, ожидаемые и предполагаемые соотношения газообразного элемента, который должен был бы заполнить пробел между гелием и аргоном".
Таким газом оказался открытый в 1898 г. неон (в переводе с греческого - новый). А затем в короткий промежуток времени Рамзай и его сотрудник Траверс обнаружили в земной атмосфере еще два элемента: криптон (тайный) и ксенон (скрытый).
За короткое время найдено пять новых элементов. Очень странных, очень непонятных. И не потому, что все они газообразные. Азот, кислород, водород - тоже газы, но это никого не удивляло. Все пять новых газов словно бы и не обладали химическими свойствами. Как ни старались ученые, им не удавалось заставить гелий, аргон и их спутников вступить в химическое взаимодействие с другими элементами. Потому и закрепилось за новыми элементами общее название инертные, или благородные, газы.
Вполне реальным оказался вопрос об их месте в периодической системе. Но подходящего места не находилось - ни в одной из групп таблицы элементов свободных вакансий не было. Да если бы и отыскались, все равно инертные газы не подошли бы по свойствам. Точнее сказать: из-за отсутствия химических свойств.
Стало быть, существуют на Земле элементы, для которых нет места в периодической системе. Но какова же тогда ценность классификации, если за её бортом остаются целых пять элементов? Основа классификации - периодический закон.
Следовательно, закон оказывается неточным, неполным.
Вот так примерно рассуждали те ученые, которые видели в инертных газах "мину", способную подорвать стройный каркас периодической системы. И по-своему были правы.
Однако к прочим своим достоинствам система добавила еще одно: гибкость. В феврале 1900 г. в Берлине встретились Менделеев и Рамзай - два человека, которые больше чем кто-либо были заинтересованы в решении проблемы места инертных газов. И ученые предложили решение, притом чрезвычайно простое: разместить инертные газы в системе между галогенами и щелочными металлами так, чтобы они образовали самостоятельную нулевую группу.
Структура периодической системы от этого ничуть не пострадала: она приобрела еще большую законченность и стройность. Первое испытание благополучно осталось позади.
Впрочем, не обошлось без ложки дегтя: атомный вес аргона оказался больше, чем у калия. Словом, тот же "непорядок", как и в случае теллура и йода, кобальта и никеля.
Маленькая, но важная интермедия
История науки знает немало курьезных и удивительных совпадений. Но это особенно любопытно: ровно через 27 лет после того, как Менделеев набросал "Опыт системы элементов...", день в день, 1 марта 1896 г. французский физик А. Беккерель открыл явление радиоактивности. Оно заключалось в испускании минералами урана невидимых лучей, способных проникать через непрозрачные тела и действовать на фотографические пластинки.
Вскоре оказалось, что свойством излучать обладает именно уран; затем такое же качество обнаружилось у тория. В изучение нового явления включилась большая группа исследователей. Среди них были французские ученые Мария и Пьер Кюри, английский ученый - Эрнст Резерфорд. Их трудами были заложены основы учения о радиоактивности.
С тех пор два великих открытия XIX в. - периодический закон и радиоактивность - стали развиваться параллельно, часто соприкасаясь. И в местах их соприкосновения рождались и рождаются удивительные гипотезы и открытия, которые оказали огромное влияние на познание человеком структуры и свойств вещества.
Еще одно испытание периодической системы.
Все началось с того, что Мария Кюри обнаружила: некоторые урановые минералы обладают гораздо более сильной радиоактивностью, чем сам уран. Возникло подозрение, что эта активность принадлежит новым, неизвестным пока радиоактивным элементам. Супруги Кюри взялись за их поиски. Им удалось раздобыть несколько тонн отходов от переработки урановой руды. Эту гору материала они перерабатывали несколько месяцев. Беспримерный, поистине героический труд принес блестящие плоды. В июле 1898 г. ученые объявили об открытии полония (названного так в честь родины Марии Кюри - Польши), а в декабре - радия (от греческого "радиус", т. е. луч) - двух новых радиоактивных элементов. Годом позже сотрудник Кюри А. Дебьерн открыл актиний - еще одно новое радиоактивное вещество.
Мы не случайно употребили слово "вещество". Перечисленные выше открытия новых элементов были необычными. Когда, например, Лекок де Буабодран открыл галлий, то уже вскоре он располагал такими количествами его соединений, что их можно было взвесить на грубых весах.
Открытия полония, радия, актиния были сделаны косвенным путем. В результате долгих химических операций удавалось сконцентрировать вещество с высокой радиоактивностью. Измерив ее, делали вывод о том, что вроде бы обнаружено новое. Но было ли это вещество соединением одного радиоактивного элемента или нескольких, однозначного ответа дать было нельзя. Притом эти элементы содержались в исчезающе малых количествах.
Чтобы их изучать, химикам пришлось менять привычный образ действий. Научиться работать с такими количествами радиоактивных элементов, которые измерялись ничтожными долями миллиграмма, и судить о ходе химических операций, контролируя его посредством измерения интенсивности радиоактивных излучений. Так родилась новая наука радиохимия.
Лишь гениальная интуиция и исключительные способности экспериментаторов позволили супругам Кюри сделать предположение, что полоний должен быть аналогом теллура, а радий - аналогом бария. Но чтобы это доказать, потребовалось несколько лет кропотливых и разносторонних исследований. Каких, например, трудов стоило правильно определить атомный вес радия! И для этих двух новых элементов Менделеевым были предусмотрены места в периодической таблице: радий занял место экабария, а полоний был предсказан под названием двителлура.
А вот актиний долгое время не находил себе определенного пристанища в таблице: таким коварным, таким капризным оказался этот элемент.
Но Менделеев, как вы уже знаете, оставил в конце шестого и начале седьмого периода системы элементов несколько пустых клеток: пять между висмутом и торием и одну между торием и ураном. Для трех новых радиоактивных элементов места вполне хватало.
1900-й год принес неожиданный сюрприз: три радиоактивных вещества, притом газообразных. Если препараты, содержащие радий, торий или актиний, поместить в замкнутые сосуды, а затем, спустя некоторое время, откачать оттуда воздух, то радиоактивные незнакомцы удаляются вместе с ним. Их назвали эманациями (от латинского "эманио" - истекать): эманация радия, эманация тория, эманация актиния. Потом их имена стали короче: радон, торон и актинон.
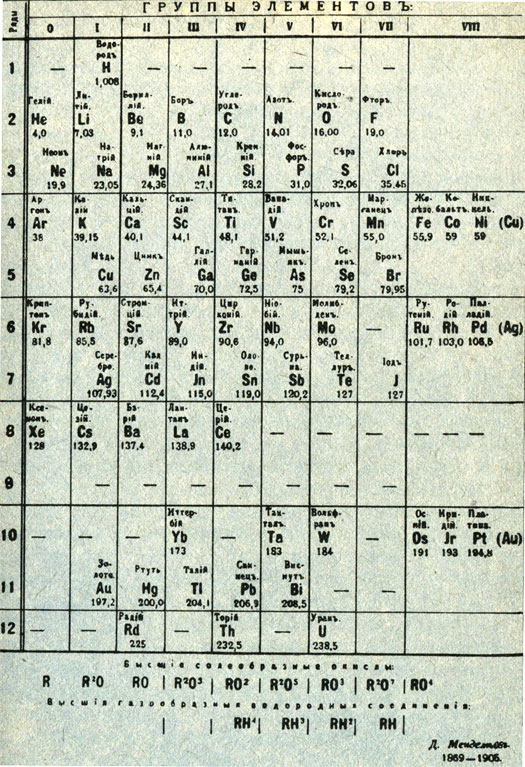
Эта периодическая система была помещена в восьмом издании 'Основ химии', которое вышло в 1906 г. и было последним при жизни автора. В ней значительно меньше пустых клеток. Уже заняли свои места предсказанные Менделеевым галлий, скандий и германий, уже открыт радий, который также был предсказан Менделеевым и описан под названием экабария. Открыты благородные газы, нашедшие свое место в таблице в новой, нулевой группе. Еще недостаточно изучены редкие земли, и их положение в таблице пока не определилось
Что это: три новых самостоятельных радиоактивных элемента, подобно тому как различаются торий и уран, полоний и радий? И, собственно говоря, откуда они появляются, откуда истекают - три загадочные эманации?
Ответы на эти вопросы, которые нашли ученые, имели поистине историческое значение и для дальнейшей судьбы закона периодичности, и для всего последующего развития учения о радиоактивности.
Радон, торон и актинон нельзя было химическим путем отделить друг от друга, т. е. все они словно имели одно и то же лицо. Следовательно, в разные клетки периодической системы их поместить было бы едва ли верно, хотя, как выяснилось позднее, они различались по атомным весам. И доступные оценке и изучению свойства трех эманации оказывались такими, что их можно было бы рассматривать как тяжелые аналоги инертных газов. Как "экаксеноны".
Итак, если радон, торон и актинон - химические элементы, то, во-первых, они химически инертны, а во-вторых, если пытаться разместить их в таблице Менделеева, то в ней находится только одна незаполненная клетка, предназначающаяся для самого тяжелого инертного газа.
И вот перед периодическим законом появляются два трудных вопроса: 1) как объяснить, что элементы, различающиеся по атомным весам, совершенно неотличимы по свойствам и 2) если важнейший принцип системы "каждому элементу свое место", то как быть, когда на одно место претендуют сразу три элемента?
И в первое десятилетие нашего века эти вопросы, с каждым годом становясь все острее, словно дамоклов меч висели над периодической системой Менделеева.
Проблема происхождения эманации волновала не меньше. Создавалось впечатление, что они словно возникают из ничего.
Английские ученые Э. Резерфорд и Ф. Содди пришли к выводу, что радиоактивный распад сопровождается превращением химических элементов. Из одного элемента возникает другой. Следовательно, понятие об атоме как неделимой, неизменяемой частице материи рухнуло.
Ученые доказали, что радиоактивность - свойство атома. При распаде радиоактивный атом мог испускать два сорта лучей, представляющих поток материальных частиц, обозначаемых греческими буквами α и β. Так вот, α-частицы это положительные двухзарядные ионы гелия, а β-частицы - это не что иное, как электроны. Поскольку α-частицы имеют довольно большую массу (атомный вес гелия равен ~ 4), то, теряя ее, радиоактивный атом уже не может оставаться самим собой. Он должен превратиться в атом более легкого элемента, с атомным весом на 4 единицы меньше.
Именно так возникали и эманации. Вот, например, процесс "рождения" радона:
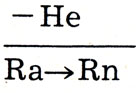
На этой первой в истории изученной цепочке превращения элементов Резерфорд и Содди построили в 1902 г. теорию радиоактивного распада, основанную на гипотезе о превращении элементов. А спустя год Содди и Рамзай доказали присутствие гелия наряду с радоном над препаратом радия.
Так стало понятно, откуда берутся эманации. Смутно вырисовывалась догадка: все радиоактивные элементы каким-то образом связаны между собой. Были, правда, шаткие основания полагать, что могут существовать три независимых ряда радиоактивных превращений. Они начинаются соответственно ураном, актинием и торием и заканчиваются нерадиоактивным свинцом. Правда, для более строгих выводов не хватало промежуточных веществ. Они, однако, не заставили себя долго ждать.
Десять, двадцать, тридцать новых радиоактивных веществ за считанные годы обнаружили ученые. Это был словно залп картечью по периодической системе, которая перед лицом грозных фактов представлялась не очень-то защищенной мишенью.
Их, этих "радиоэлементов" (мы взяли это слово в кавычки, ибо ученые терялись в догадках: подлинные ли это химические элементы или какая-то промежуточная форма материи), появлялось столь много, что было бессмысленно придумывать им специальные названия. Номенклатура здесь установилась иная. Были Х-продукты: уран-Х, торий-Х; были радий-А, радий-В, радий-С; были радиоактиний и радиоторий. Удобство номенклатуры заключалось в том, что она позволяла сразу оценивать принадлежность того или иного "радиоэлемента" к определенному ряду радиоактивных превращений.
Постепенно все "радиоэлементы" находили место в том или ином радиоактивном семействе - ториевом, урановом или актиниевом. Эти семейства оказывались своеобразными систематиками "радиоэлементов".
Но как совместить эти семейства со структурой менделеевской периодической системы?
Уже несколько примеров полнейшей химической неразличимости "радиоэлементов" имели химики. Несколько совокупностей "радиоэлементов", заметно различавшихся по атомным весам, ничем не отличались по свойствам, кроме радиоактивных. Это была одна крайность. Другая состояла в том, что было немало случаев, когда "радиоэлементы" имели одинаковые атомные веса, но ничего общего в своих свойствах.
Эти две крайности нужно было либо как-то увязать с периодическим законом и периодической системой, либо...
Либо признать, что "все эти факты пробили широкую брешь в принципе, который был положен Менделеевым в основание его системы", как сказал известный французский химик Ж. Урбэн.
Либо принять, что "периодическая система, строго говоря, не вмещает всех известных элементов", как заметил другой, не менее известный немецкий химик В. Тильден.
Вот перед каким грозным испытанием оказалась периодическая система.
Посмотрим теперь, как она его выдержала.
Как же устроен атом?
Когда в 1897 г. англичанин Дж. Томсон и немец Э. Вихерт независимо друг от друга открыли электрон, то ученые разных стран тут же поспешили использовать его для объяснения строения атома. Но вот какая вышла неувязка: ведь электроны несут отрицательный заряд, а атом в целом - незаряженная частица материи. В чем же состоит секрет, как устроен положительный "противовес" электронам?
Этот носитель положительного заряда оказывался слабым местом моделей атома, появившихся в первое десятилетие нашего века.
Тем временем Э. Резерфорд в своей лаборатории настойчиво изучал природу и поведение α-частиц. Он был первым, кто доказал: α-частица - это двухзарядный ион гелия.
Резерфорда чрезвычайно интересовало, как ведут себя α-частицы при столкновении с различными материалами, например с тонкими металлическими пластинками.
В феврале 1909 г. его ученики Г. Гейгер и Е. Марсден наблюдали удивительный факт. Они обстреливали α-частицами пластинки из золота. Большинство частиц вело себя так, как можно было предположить согласно теории: они рассеивались под определенными углами. Но некоторые отскакивали назад, словно ударяясь о массивное препятствие.
Гейгер и Марсден сочли это обстоятельство ошибкой наблюдения. Но чем больше они пытались ее устранить, тем увереннее приходили к выводу, что об ошибке здесь не может быть речи.
Резерфорд был удивлен не меньше своих учеников. Много лет спустя он вспоминал: "Это было, пожалуй, самым невероятным событием... в моей жизни. Это было почти столь же неправдоподобно, как если бы вы произвели выстрел по обрывку папиросной бумаги 15-дюймовым снарядом, а он вернулся бы назад и угодил в вас".
Если положительно заряженная α-частица, столкнувшись с "чем-то", отбрасывалась назад, как теннисный мячик, ударившийся о стенку, то это "что-то" должно было, во-первых, нести большой положительный заряд, а во-вторых, обладать большой массой. То есть быть (и в этом состояла смелая догадка Резерфорда) не чем иным, как ядром атома.
Так родилась ядерная, или планетарная, модель атома: в центре его массивное, положительно заряженное ядро, а вокруг, как планеты вокруг Солнца, по орбитам движутся электроны. В мае 1911 г. Резерфорд опубликовал статью, в которой четко и аргументированно изложил свою идею.

Этот документ имеет для истории учения о периодичности тоже очень важное значение. На фотографии ясно видно, как закономерно смещаются линии рентгеновских спектров при переходе от одного элемента к следующему
Но чему численно равны заряды ядер атомов различных элементов? Эксперименты и расчеты показывали, что для легких элементов - примерно половине атомного веса. Для элементов же середины и конца периодической системы это соотношение не оправдывалось.
В 1913 г. мало кому известный голландский ученый А. ванден Брук предположил: заряд ядра атома любого элемента численно равен порядковому номеру элемента в периодической системе.
Во всей истории периодического закона эта интуитивная догадка была одной из. самых гениальных и одной из самых важных для последующего его развития. Она почти сразу лее получила опытное доказательство. Это доказательство нашел молодой английский физик Г. Мозли, который в расцвете сил и таланта погиб во время первой мировой войны. В том же, 1913 г., изучая рентгеновские спектры элементов, Мозли показал, что длина волны характеристического рентгеновского излучения закономерно изменяется при переходе от одного элемента к последующему, т. е. зависит от порядкового номера элемента.
Измерив длину волны, можно было вычислить порядковый номер. И этот номер действительно оказался равным величине положительного заряда в ядре атома элемента.
А все эти открытия означали, что периодический закон уже на новом, более высоком уровне знаний получил физическое обоснование. По-иному зазвучала его формулировка: свойства элементов и их соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Не величины атомных весов, которые хотя и возрастали в целом при переходе от элемента к элементу, но возрастали, не повинуясь какой-либо четкой закономерности, а целочисленные значения зарядов ядер легли в фундамент закона периодичности. Целочисленные значения, изменяющиеся от элемента к элементу точно на единицу.
Следовательно, теперь можно было совершенно определенно сказать, что периодическая система, начиная от водорода (порядковый номер Z = 1) и кончая ураном (Z = 92), должна была содержать 92 элемента. Не меньше и не больше.
Следовательно, далее, ученые могли теперь с полной ясностью утверждать, какие же именно элементы еще были не открыты.
Это элементы, порядковые номера которых равны 43 и 75 (аналоги марганца, которые предсказывал Менделеев), 61 (таинственный редкоземельный элемент, чье место между неодимом и самарием) и 72 (аналог циркония, существование которого также предвидел Менделеев).
Мы не сказали еще о трех элементах с порядковыми номерами 85, 87 и 91. Все они относятся к "радиоактивной области" периодической системы. А обсуждая эту область, мы остановились на том, что в ней накопились такие загадки, объяснить которые периодическая система оказывалась бессильной.
В самом деле, как примирить с ее структурой неожиданное изобилие "радиоэлементов"? Как разместить их в ограниченном количестве ее клеток? И наконец, что же такое сами "радиоэлементы"?
Закон радиоактивных смещений и изотопы.
Вот что твердо знали ученые к 1913 г.
Все "радиоэлементы" группируются в три семейства: ториевое (родоначальник торий, атомные веса всех входящих в него радиоэлементов подчинены формуле 4n), урановое (родоначальник - уран, формула атомных весов 4n + 2) и актиниевое (актиний, 4n + 3) - в этих формулах n - целое число. Конечно, были неувязки и сомнения в частностях, но в целом ученые твердо знали, что постепенное превращение радиоактивных элементов в стабильный свинец происходит в результате последовательных α- и β-превращений.
Знали ученые и другое: как изменяется химическая природа элемента, когда он претерпевает α- или β-распад.
При α-распаде атом теряет два положительных заряда и четыре единицы массы. Еще в 1910 г. Содди сумел высказать предположение, что образующийся в результате α-распада элемент перемещается на две группы влево по периодической системе по отношению к исходному. Например, радий (вторая группа) превращается в радон (нулевая группа).
С β-распадом дело обстояло сложнее. Ведь масса атома при этом фактически не изменяется (было известно, что масса электрона составляет примерно 1/1840 часть массы атома водорода). Следовательно, должен увеличиваться на единицу положительный заряд атома, потому что электрон уносит с собой единицу отрицательного заряда. Пока ученые четко не представляли, чему соответствует положительный заряд, они могли лишь косвенно оценивать, куда переходит элемент в результате β-распада. И оказалось, что при этом он сдвигается на одно место вправо по периодической системе.
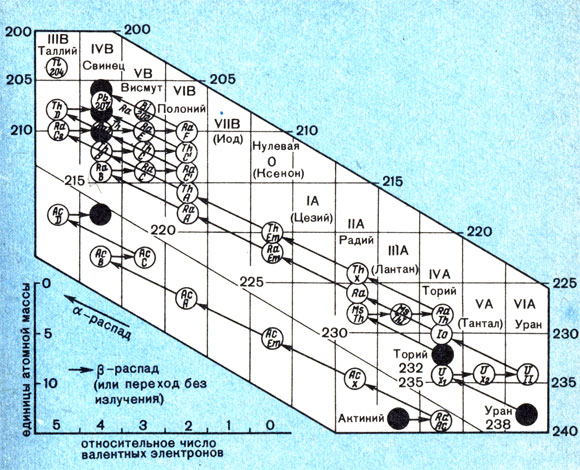
Эту диаграмму привел в своей работе, посвященной закону радиоактивных смещений, Ф. Содди. Она показывает, какая тесная связь существует между радиоактивными семействами и структурой периодической системы
Все эти наблюдения обобщили в начале 1913 г. Ф. Содди и польский химик К. Фаянс, которые сформулировали закон радиоактивных смещений: при α-распаде радиоактивный элемент превращается в элемент, отстоящий от исходного на два места периодической системы влево, а при β-распаде - на одно место вправо.
Но ученые знали и другие факты. Например, были известны три "радиоэлемента", обладающие свойствами тория и различными атомными весами; и никакими химическими способами их нельзя было отделить друг от друга. Или по три разновидности полония и радона. Или, наконец, семь разновидностей свинца, из которых было три стабильных (они завершали радиоактивные семейства) и четыре радиоактивных (они возникали в результате последовательных α- и β-распадов внутри семейств).
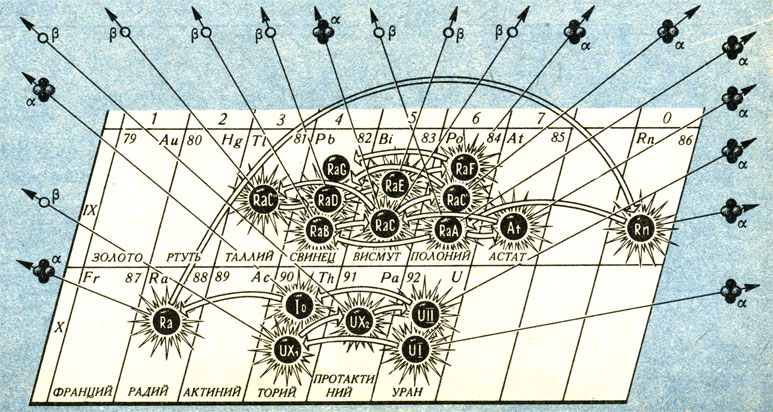
Нужно внимательно проследить за путешествием потомков атома урана по периодической системе. При каждом β-распаде у них меняется заряд, а при α-распаде - и масса. Что же определяет химические свойства получающегося ядра? Теперь не пользуются устаревшими названиями (UI, UX1 и т. п.). Принято называть изотопы просто по названиям элементов с добавлением массового числа. Вместо UI говорят 238U, вместо UX1 - 234Th. Составьте сами таблицу изотопов, образующихся при распаде урана-238
Уже давно мелькала смутная догадка, что атомы одного и того же химического элемента, быть может, неоднородны. Ее высказывали, например, немецкий химик А. Кекуле (предложивший структурную формулу бензола) и наш знаменитый химик А. М. Бутлеров (автор теории строения органических соединений). В наиболее четкой форме ее высказал Крукс, который считал, что у каждого элемента имеются разновидности, различающиеся по атомным весам. Дальше догадок дело, однако, не шло, потому что ни подтвердить их, ни опровергнуть опытным путем не удавалось.
И только в 1913 г. (видите, как богат выдающимися открытиями этот год!) Содди, на примере радиоэлементов, облек эту догадку в плоть и кровь. Он предложил рассматривать "радиоэлементы" с одинаковыми химическими свойствами как разновидности одного и того же радиоактивного элемента. Например, три эманации как разновидности одного химического элемента со свойствами инертного газа.
Эти разновидности Содди назвал изотопами. Слово "изотоп" происходит от греческих "изос" (одинаковый) и "топос" (место).
Таким образом, изотопами оказывались разновидности одного и тогб же химического элемента, занимающие одну и ту же клетку в периодической системе. По Содди, изотопы имели одинаковые заряды ядер атомов, но разные атомные веса.
Вскоре выяснилось, что явление изотопии присуще не только "радиоактивной области" периодической системы, но и многие стабильные элементы обладают изотопами. Первоначально стабильные изотопы были найдены у неона. Это открытие сделали Дж. Томсон и его ученик Ф. Астон.
Чтобы объяснить истинную причину изотопии, нам придется немного забежать вперед. В 1932 г. была открыта элементарная частица нейтрон, лишенная заряда. Ученые предложили и обосновали протонно-нейтронную модель ядра. Число протонов в ядре атома данного элемента строго постоянно. Оно определяет величину его положительного заряда и равно порядковому номеру элемента. Число лее нейтронов может колебаться в довольно широких пределах. Поэтому изотопия связана со строением ядра. У изотопов число нейтронов различно, а число протонов всегда одно и то же.
Так периодическая система с честью преодолела и это грозное испытание.
Новый смысл и значение атомного веса (атомной массы).
Менделеев считал, что химические свойства элементов определяются его атомным весом. Это оказалось не так. Место в периодической системе, а следовательно и всю химию элемента определяет не его атомный вес (точнее, его атомная масса), а порядковый номер - заряд его ядра.
А что же, атомный вес совсем утратил свое значение и теперь используется лишь при расчетах анализов химического состава вещества?
Ни в коей мере! В любом издании периодической системы элементов под символом каждого элемента написано значение его атомного веса.
Только вместо термина "атомный вес" физики сочли более правильным употреблять термин "относительная атомная масса", или коротко "атомная масса". Недоступный прямому восприятию, до сих пор еще никем не виданный атом ученые умеют теперь "взвешивать" с исключительно большой точностью.
Это необходимо потому, что для физики значение атомной массы неизмеримо выросло. Масса атома стала основной величиной для расчетов ядерной энергетики и ядерной химии. Не зная точных значений атомных
Расе, нельзя установить механизм ядерных реакций и рассчитать количество энергии. Вот, например, с какой точностью измеряются теперь массы атомов:

Погрешность при измерении атомных масс, не ревышающая последней значащей цифры, как видно из этих примеров, составляет всего миллиардную долю от измеряемой величины. Правда, в повседневной практике химики обходятся двумя, иногда тремя знаками после запятой.
Когда были открыты изотопы, выяснилось, почему томные массы элементов, как правило, дробные числа от элементов, имеющих несколько изотопов, эти изотопы содержатся в разном количестве. Различное их содержание и учитывается при исчислении атомной массы.
Не надо путать два понятия: массовое число и атомная масса изотопа. Массовое число представляет собой сумму числа протонов и числа нейтронов, содержащихся в ядре атома данного изотопа. Оно всегда целое. У радиоактивных элементов вместо атомной массы обычно под символами в таблице пишется массовое число наиболее долгоживущего изотопа (т. е. имеющего наибольший период полураспада). Атомная масса изотопа - это действительная масса атома изотопа, непосредственно измеренная на опыте с помощью масс-спектрометра. Она никогда не равна сумме масс протонов, нейтронов и электронов, образующих атом. Энергия связи этих частиц в атоме вносит очень существенную поправку. Атомная масса изотопа никогда не выражается целым числом.
Рассказывая об атомной массе, мы попросим запомнить следующее соотношение:
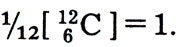
История его такова.
При составлении самого первого варианта системы элементов Д. И. Менделеев принимал атомную массу водорода равной единице и сравнивал с ней атомные массы всех других элементов.
На Международном съезде химиков в 1860 г. было решено принять водород за основу шкалы атомных весов. Почти полстолетия самый легкий элемент водород занимал это почетное место. Только в 1906 г. химики перешли к кислородной шкале, за основу шкалы атомных весов был принят атомный вес кислорода - его 1/16 часть. Это, конечно, было гораздо удобнее, так как кислород образует соединения почти со всеми элементами.
Когда же было открыто, что в природе существует три различных изотопа кислорода и что содержание их в природном кислороде непостоянно, физики установили для себя "физическую" шкалу атомных весов. Они условились принять за единицу 1/6 массы атома наиболее распространенного легкого изотопа кислорода и атомный вес его считать равным точно 16. Это устраняло погрешность, которая возникала из-за непостоянства изотопного состава кислорода разного происхождения.
При современной высокой точности измерений такое "двоевластие" стало приводить к очень многим недоразумениям и ошибкам. Кроме того, выяснилось, что изотоп 160 не оправдывает возлагавшихся на него надежд и не может обеспечить необходимую точность. Он оказался неудобным эталоном для атомных масс.
И поэтому в 1958-1961 гг. ученые еще раз пересмотрели этот исключительно важный для всего естествознания вопрос: что должно быть положено в основу современной шкалы точных атомных масс? Из всех элементов только два могли претендовать на почетную роль основной константы химии и физики - фтор и углерод.
У фтора только один изотоп, и атомная масса элемента фтора - постоянная величина. Углерод имеет два стабильных изотопа, но зато его соединения с водородом очень удобны для непосредственного сравнения масс атомов различных изотопов почти всех элементов.
Поскольку и "фторная" и "углеродная" шкалы для атомных масс обладали каждая важными и ценными преимуществами, было решено провести всемирный опрос ученых химиков и физиков: какую шкалу они предпочитают? В этом всемирном опросе приняли участие и ученые нашей страны. Победил углерод. Было решено за основу новой единой шкалы атомных масс принять атом наиболее распространенного изотопа углерода 12С и считать
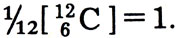
После открытия изотопии удалось понять, почему у соседних элементов: аргон-калий, кобальт-никель, теллур-иод атомные массы предшествующих элементов больше, чем у последующих. Оказалось, что у аргона, кобальта и теллура изотопы с наибольшими атомными массами самые распространенные. Напротив, калий, никель и иод не отличаются высоким содержанием более тяжелых изотопов. А ведь мы уже знаем, что на величину атомной массы элемента влияет процентное содержание его изотопов. Поэтому у первых
элементов в парах Аr-К, Со-Ni, Те-J атомные массы больше.
Но распространенность изотопов в природе такая, что атомные массы элементов, за исключением трех случаев, растут параллельно увеличению заряда ядра атома. Почему это так, а не иначе - вопрос очень сложный, и для его понимания требуется привлекать данные ядерной физики, а также астрофизики, изучающей процессы происхождения химических элементов в результате ядерных реакций на звездах.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'