
Периодический закон - закон строения атома
В свое время Д. И. Менделеев с огорчением замечал: "...причин периодичности мы не знаем". Ему не удалось дожить до разгадки этой тайны.
Когда было доказано, что порядковый номер элемента в системе численно равен заряду ядра его атома, то стала ясной физическая сущность периодического закона.
Но почему свойства химических элементов изменяются периодически по мере роста заряда ядра? Почему система элементов построена так, а не иначе и ее периоды содержат строго определенное число элементов? На эти важнейшие вопросы ответа пока не было.
Тайна периодической системы элементов была разгадана, когда удалось понять сложнейшую структуру атома, строение его внешних электронных оболочек, законы движения электронов вокруг положительно заряженного ядра, в котором сосредоточена почти вся масса атома.
Все химические и физические свойства вещества определяются строением атомов. Периодический закон, открытый Менделеевым, есть всеобщий закон природы, потому что он опирается на закон строения атома.
Как ученые познавали строение атома?
Планетарная модель атома, предложенная Резерфордом, быстро получила всеобщее признание. Правда, ученые не имели четкого представления, из каких частиц состоит ядро атома и как и в каком количестве располагаются электроны на его орбитах.
Об атомном ядре у нас еще пойдет речь. Электроны... Разве в руках исследователей были какие-нибудь надежные способы узнать, как ведут себя атомные электроны?
Оказывается, были. Проникнуть в тайну распределения электронов помогло изучение спектров. Атом как бы сам рассказывал о себе на удивительном и красочном языке - на языке спектральных линий испускаемого атомом света. Каждая спектральная линия - это свидетельство того, что электрон изменил свое расположение относительно атомного ядра. Изучая спектры различных элементов, ученые сумели подметить в спектрах важные закономерности, сходства и различия.
Именно благодаря изучению спектров - оптических и рентгеновских - удалось более или менее детально установить, как именно расположены электроны вокруг атомного ядра.
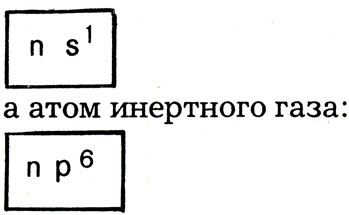
Самый важный вывод состоял в том, что электроны распределяются по определенным оболочкам, причем в каждой из оболочек должно содержаться строго определенное число электронов. Для обозначения таких оболочек, заимствованного, кстати, из спектральной теории, ученые использовали латинские буквы К, L, М, N, О, Р, Q и т. д. Так, ближайшая к ядру оболочка обозначалась как К-оболочка, следующая - как L-оболочка и т. п.
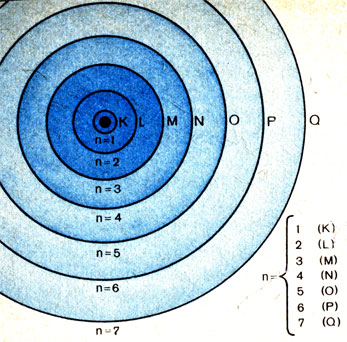
Схема последовательного расположения электронных оболочек в атоме. Номер оболочки равен главному квантовому числу n; энергии электронов пропорциональны значению n
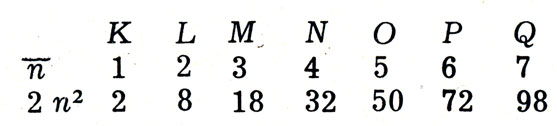
Другой существенный момент заключался в возможности выяснить, какое максимальное число электронов может содержаться на каждой оболочке. Оказалось, что оно определяется по формуле 2n2, где n - номер оболочки.
Посмотрите, какими емкостями обладают отдельные электронные оболочки:
Наконец, третий замечательный результат приводил к выводу, что внутри каждой оболочки не все электроны одинаковы, а их можно объединить в определенные группы. Располагая такими сведениями об атомах, попытаемся теперь объяснить устройство периодической системы.
Самое главное в построении периодической системы.
Казалось бы, самое главное - это то, что периодическая система отражает периодическое изменение свойств химических элементов по мере возрастания зарядов ядер их атомов (Z) и объединяет сходные по свойствам элементы в рамках определенных групп.
Например, все галогены - фтор, хлор, бром, иод, астат размещаются в VII группе системы. Но мы видим, что в той же группе в виде параллельного вертикального ряда размещены еще три элемента - марганец, технеций и рений. Они тоже сходны друг с другом. Но почему они попали в одну группу с галогенами? Это интересный и важный вопрос, и в свое время мы дадим на него ответ.
Пока же давайте заметим, что каждая группа периодической системы подразделяется на две подгруппы - главную (а) и побочную (б). В нагнем примере галогены составляют а-подгруппу, а марганец и его аналоги - б-подгруппу.
И все же для объяснения структуры периодической системы, такой, как ее разработал Д. И. Менделеев, все это еще не самое главное.
Быть может, самое главное - это понятие о периодах. Действительно, система потому называется периодической, что она представляет совокупность периодов. Каждый период содержит строго определенное число элементов, начинается щелочным металлом и заканчивается инертным газом. Исключение составляет только первый период, начинающийся с газообразного водорода. Все это, разумеется, чрезвычайно важно, но все-таки тоже еще не самое главное.
Закон Мозли позволил однозначно определить число элементов в каждом периоде системы:

Среди чисел химических элементов в периодах нет ни одного, которое бы уже не встречалось в схеме распределения электронов по определенным электронным оболочкам. Но такое совпадение может привести к выводу: в атомах элементов на протяжении одного периода происходит заполнение определенной электронной оболочки.
Иначе говоря, число элементов в периоде равно числу электронов в соответствующей оболочке. Тогда связать построение периодической системы со строением атома было бы чрезвычайно просто. И такая связь оказалась бы до удивления очевидной.
Но в действительности подобное совпадение наблюдается только для первого и второго периодов системы. Они содержат соответственно 2 и 8 элементов. Столько же электронов содержат первая и вторая электронные оболочки. Третья включает 18 электронов. Третий же период состоит, как и второй, из 8 элементов.
Таким образом, заманчивое равенство: емкость периода = емкости электронной оболочки - выполняется, как сказали бы математики, в очень ограниченных условиях.
Стало быть, периодическая система построена по более сложному закону, нежели система последовательных электронных оболочек.
Тут-то мы и можем наконец сказать: самым главным оказывается то, что в периодической системе емкости периодов, начиная со второго, попарно повторяются. Лишь первый период, состоящий из водорода и гелия, остается в одиночестве.
Чтобы объяснить структуру периодической системы, необходимо было установить причину повторяемости периодов. Установить, опираясь на те данные, которыми уже располагала наука о строении атома.
Электронные оболочки заполняются ступенчато.
Установлению действительной связи между строением атома и структурой периодической системы наука обязана в первую очередь великому датскому физику Н. Бору. Он же был первым, кто объяснил истинные причины периодического изменения свойств элементов. Бор начал с того, что сделал жизнеспособной резерфордовскую модель атома. Согласно всем классическим законам, электрон, вращаясь вокруг ядра, постепенно терял свою скорость. В определенный момент он должен был остановиться и упасть на ядро. То есть, если "планетарный" атом и мог бы существовать, то ничтожное время. Между тем атомы были везде и повсюду и не выказывали тенденции разваливаться.
Нильс Бор преодолел это противоречие, допустив, что электроны вокруг ядра вращаются не по любым, а по определенным орбитам, и, находясь на них, не теряют энергии. Лишь переходя с орбиты на орбиту, электроны, как говорят физики, излучают или поглощают кванты света. Визитная карточка: определенная линия в спектре. Такие "разрешенные" орбиты получили название квантовых, а за Бором укрепилась слава создателя квантовой (не путать с квантовомеханиче-ской! - см. далее) теории атома. И, опираясь на эту теорию, Бор начал объяснять строение периодической системы.
В атоме водорода и гелия заполняется К-оболочка, содержащая два электрона. У гелия она заполнена, и потому он инертный газ - в силу прочности заполненной оболочки. К тому времени (к началу 20-х годов) ученые уже понимали, что химические свойства элементов должны определяться числом и расположением электронов на внешних оболочках.
Второй период - от лития до неона - 8 элементов и 8 электронов в L-оболочке.. Восьмиэлектронная внешняя оболочка (так же как и двухэлектронная у гелия) весьма прочное образование. А потому неон - инертный газ. Вступая в химические реакции, атомы элементов должны либо терять, либо приобретать электроны. Атому неона невыгодно ни то, ни другое.
В третьем периоде также 8 элементов - от натрия до аргона. Но в третьей, М-оболочке должно быть 18 электронов. Восемь вакансий заполняются в атомах элементов третьего периода, аргон, по понятной причине (8 электронов на внешней оболочке), снова инертный газ. Десять мест для электронов М-оболочки пока остаются свободными. У каких элементов продолжится заполнение свободных вакансий?
За аргоном следуют калий и кальций. Быть может, у них? Вряд ли. Это типичные щелочной и щелочноземельный металлы, и, как свидетельствует опыт предыдущих периодов, второго и третьего,- лития и бериллия, натрия и магния,- с калия должно начаться заполнение новой, N-оболочки и тем самым построение нового, четвертого периода системы. Думается, вы уже усвоили простую истину: каждый период (кроме первого) начинается с щелочного и щелочноземельного металлов, а в атомах этих элементов начинает заполняться новая оболочка.
Всего в четвертом периоде 18 элементов. Стало быть, в их атомах должны каким-то образом распределяться 10 электронов из М-оболочки и 8 электронов из N-оболочки. В какой строгой последовательности - Бор пока не знал.
Зато он твердо установил фундаментальное положение: заполнение электронных оболочек в атомах химических элементов происходит, начиная с третьей, М-оболочки, не последовательно, постепенно до полной емкости (т. е. так, как это было у К- и L-оболочек), а ступенчато. Иначе говоря, построение электронных оболочек на время прерывается из-за того, что в атомах появляются электроны, принадлежащие другим оболочкам.
Чтобы понять теорию Бора, придется познакомиться со своеобразной атомной азбукой. Только с ее помощью можно наглядно изложить сокровенные тайны атомов.
Четыре буквы атомного алфавита.
Эти буквы обозначаются необычно: n, l, ml, ms и на языке атомной физики называются квантовыми числами. Исторически они вводились постепенно, и их возникновение в значительной степени связано с изучением атомных спектров.
Так вот оказывается, что состояние любого электрона в атоме можно записать особым шифром, представляющим собой комбинацию четырех квантовых чисел. Это не просто какие-то отвлеченные величины, используемые для записи электронных состояний. Напротив, все они имеют реальное физическое содержание.
С числом n вы встречались несколькими страницами раньше; оно входит в формулу для емкости электронной оболочки (2n2). То есть n соответствует номеру электронной оболочки; иными словами, оно определяет принадлежность электрона к данной электронной оболочке.
Называемое главным квантовым числом, число п принимает только целочисленные значения
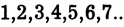
отвечающие соответственно оболочкам
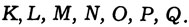
Например, когда говорят, что электрон характеризуется значением n = 4, то это означает, что он принадлежит к N-оболочке. Поскольку n входит в формулу для энергии электрона, то говорят, что главное квантовое число определяет общий запас энергии электрона в атоме.
Другая "буква" нашего алфавита - орбитальное (или побочное) квантовое число - обозначается как l. Оно было введено, чтобы подчеркнуть неравноценность всех электронов, принадлежащих данной оболочке.
Оказывается, каждая оболочка подразделяется на определенные подоболочки, причем их число равно номеру оболочки. Вы сами легко сообразите, что К-оболочка (n = 1) состоит из одной подоболочки; L-оболочка (n = 2) - из двух; М-оболочка (n = 3) - из трех под оболочек...
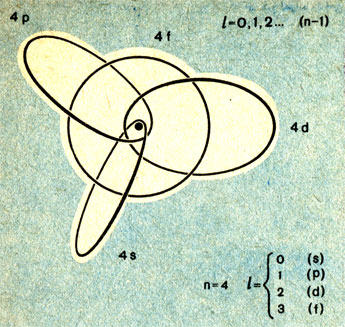
Орбитальное квантовое число l определяет типы орбит, возможных при данном значении n. На рисунке показана схема всех типов электронных орбит только одной N-оболочки атома. Вы сами можете начертить такую схему для любой другой оболочки. Только нужно иметь в виду, что отношение l полуосей в эллипсах должно быть равно
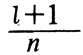
И вот каждая подоболочка данной оболочки характеризуется определенной величиной n. Орбитальное квантовое число принимает также целочисленные значения, но начиная с нуля, т. е. 0,1,2,3... Таким образом, l всегда меньше n. Легко понять, что при n = 1, l = 0; при n = 2, l = 0 и 1: при n = 3, l = 0, 1 и 2 и т. д. Следовательно, l меняется от 0 до n - 1.
Число l, если можно так выразиться, имеет геометрический образ. Ведь орбиты электронов, принадлежащих к той или иной оболочке, могут быть не только круговые, но и эллиптические.
Разные значения l и характеризуют различные типы орбит.
Физики любят традиции и предпочитают для обозначения электронных подоболочек старые буквенные обозначения s(l = 0), р(l = 1), d(l = 2), f(l = 3). Это первые буквы немецких слов, характеризующих особенности серий спектральных линий, обусловленных переходами электронов: резкая, главная, размытая, фундаментальная.
Теперь можно кратко записать, какие электронные подоболочки содержатся в электронных оболочках.
Орбит только одного типа d в одной только-электронной оболочке может быть пять. Подумайте, в каких оболочках возможны такие орбиты. Правильнее представлять себе, что все они различно ориентированы в пространстве.
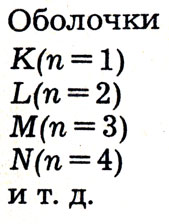
Подоболочки
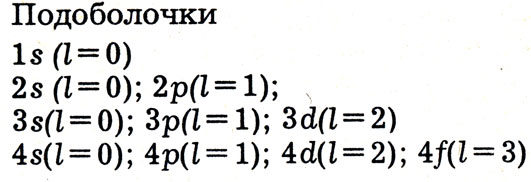
Подскажем, что цифры у буквенных обозначении подоболочек есть главные квантовые числа. Двух квантовых чисел - главного n и орбитального l-вполне достаточно, чтобы объяснить особенности строения периодической системы элементов на языке атомной теории. При условии, если знать, сколько электронов вмещают различные электронные подоболочки.
Это "сколько" нам поможет определить третье и четвертое квантовые числа - ml и ms, которые носят названия магнитного и спинового.
Раньше мы сказали, что квантовое число l определяет тип электронных орбит. Магнитное квантовое число ml тесно связано с Z и определяет, с одной стороны, направление расположения этих орбит в пространстве, а с другой-их число, возможное для данного l. Из некоторых закономерностей атомной теории следует, что при данном l квантовое число ml принимает 2l + 1 целочисленных значений: от -l до +l, включая нулевое. Например, для l=3 вот какую последовательность ml мы имеем: -3, -2, -1,0, +1, +2, +3, т. е. всего семь значений.
Почему ml называется магнитным? Каждый электрон, вращаясь на орбите вокруг ядра, по существу, представляет собой один виток обмотки, по которому идет электрический ток. Возникает магнитное поле, поэтому каждую орбиту в атоме можно рассматривать как плоский магнитный листок. При наложении внешнего магнитного поля каждая электронная орбита будет с этим полем взаимодействовать и стремиться занять в атоме определенное положение.
Оказывается, число электронов на каждой орбите определяется значением спинового квантового числа ms.
Поведение атомов в сильных неоднородных магнитных полях показало, что каждый электрон в атоме ведет себя как магнитик. А это свидетельствует, что электрон вращается вокруг своей собственной оси, словно планета на орбите. Это свойство электрона получило название "спин" (в переводе с английского - вращать). Вращательное движение электрона постоянно и неизменно. Вращение электрона совершенно необычно: ни замедлить, ни ускорить, ни остановить его нельзя. Оно одинаково для всех электронов в мире.
Но хотя спин-общее свойство всех электронов, в нем также заключена причина различия между электронами в атоме.
Два электрона, вращаясь на одной и той же орбите вокруг ядра, обладают одним и тем же спином по величине, и все же они могут различаться направлением собственного вращения. При этом изменяется знак момента количества движения и знак спина.
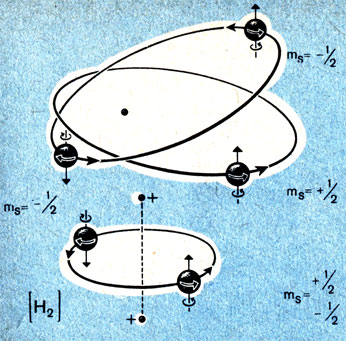
На каждой отдельной орбите может быть либо только два спаренных электрона, либо один неспаренный. Неспаренный электрон имеет большое значение для химической характеристики элемента. От него зависит образование молекул
Квантовый расчет приводит к двум возможным значениям спиновых квантовых чисел, присущих электрону на орбите:
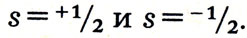
Других значений быть не может. Поэтому в атоме на каждой орбите могут вращаться либо только один, либо два электрона. Больше быть не может.
Наконец-то мы вправе сказать, что каждая электронная подоболочка максимально вмещает 2(2l + 1)-электронов, а именно:
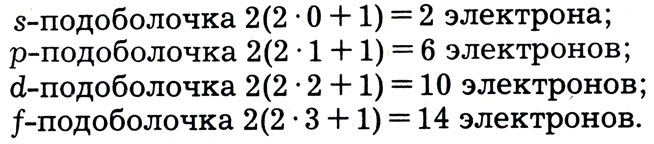
Отсюда простым сложением получаются емкости последовательных оболочек.
Вот теперь мы могли бы ответить на вопрос: что же такое основной закон строения атома?
Удивительна простота основного закона, к которому свелась первоначальная бесконечная сложность строения атома. Вся прихотливость поведения электронов в его внешней оболочке, управляющая всеми его свойствами, может быть выражена необычайно просто: в атоме нет и не может быть двух одинаковых электронов.
Теперь смысл этого закона нам ясен. Все электроны в атоме должны иметь разный набор значений четырех квантовых чисел: n, l, ml, ms. Этот закон известен в науке как принцип Паули (по имени швейцарского физика-теоретика).
Зная же общее число электронов в данном атоме, которое равно его порядковому номеру в менделеевской системе, мы можем сами "строить" атом: можем сами рассчитывать структуру его внешней электронной оболочки - определять, сколько в ней электронов и какие они в ней. Посмотрим теперь, как все это делается на практике.
Архитектура периодической системы.
Раньше, рассказывая о том вкладе, который внес Бор в объяснение периодичности, мы не упомянули об одном его важном выводе: по мере роста Z периодически повторяются сходные типы электронных конфигураций атомов. По сути, это тоже формулировка периодического закона, но применительно к процессу распределения электронов по оболочкам и подоболочкам.
Зная закон строения атома, мы можем теперь сами построить периодическую систему и объяснить, почему она построена именно так. Нам нужно лишь одно маленькое терминологическое разъяснение: те элементы, в атомах которых происходит построение s-,p-,d-,f- под-оболочек, принято называть соответственно s-,p-,d-, f- элементами.
Только надо иметь в виду, что формулу атома, по странной традиции, принято записывать в несколько необычной форме. Но к ней нетрудно привыкнуть. Главное квантовое число физики записывают соответствующей цифрой, а побочное - буквой; число же электронов помечают справа сверху. Например, в атоме водорода только один электрон, поэтому его формула имеет самый простой вид: 1s.
Итак, приступим.
Первый период содержит ls-элементы - водород и гелий. Так как s-элементов никогда не может быть больше двух, то схематическая запись первого периода следующая:
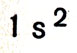
Вспомнив или перечитав то, что мы рассказывали на предшествующих страницах, вы легко сообразите, что второй период может быть изображен следующим образом:

т. е. в него входят элементы, в атомах которых заполняются 2s- и 2р-подоболочки, а третий (в нем строятся 3s- и 3р-подоболочки):

Очевидно, сходные типы электронных конфигураций повторяются, именно сходные, а не одинаковые, так как, скажем, 1s2 не то же самое, что 2s2, a 2s2 - не 3s2.
Чтобы изобразить строение четвертого периода, потребуется небольшая подсказка. В начале этого периода два 4s-элемента, т. е. начинается заполнение N-оболочки (n = 4) ранее, чем завершилось построение М-оболочки. Она, как вы уже знаете, содержит еще 10 вакантных мест, которые и заполняются у десяти последующих элементoв (Зd -элементов). Кончилось заполнение М-оболочки, продолжается заполнение N-оболочки (шестью 4р-электронами). Следовательно, строение четвертого периода изобразим так:
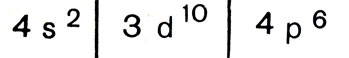
Пятый период, содержащий столько же элементов, сколько и четвертый (18), запишется аналогично:
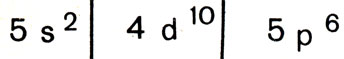
В шестом периоде 32 элемента (к s-, p- и d-элементам прибавляется новый тип: 4f-элементы). Его схематическая запись такова:
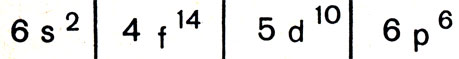
И наконец, следующий, седьмой период:
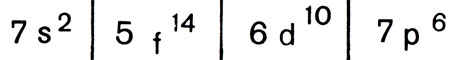
Следует только иметь в виду, что еще не все элементы седьмого периода известны. На с. 63 изображена периодическая система. Ее построение вполне соответствует тому, которое мы только что провели.
Спросим, однако, себя: ступенчатое заполнение оболочек - это лишь прием, к которому прибегали ученые, чтобы объяснить явление периодичности, или же строгая физическая закономерность?
Именно закономерность! Каждый очередной электрон, попадая в электронную оболочку, характеризуется определенной энергией (или, как говорят, он занимает определенный энергетический уровень). Сначала последовательность этих уровней такова, что соответствует монотонному заполнению электронных оболочек. А вот после того, как заполнилась 3р-подоболочка, монотонность исчезает. Оказывается, вместо того чтобы занимать уровни 3d-подоболочки, электронам выгоднее (с энергетической точки зрения) сначала заселить уровни 45-подоболочки. Вот эти-то энергетические "качели" "выгоднее-невыгоднее" и объясняют ту ситуацию, что в химических элементах заполнение электронных оболочек идет уступами. На очереди другой вопрос: почему в периодической системе аналогично построенные периоды попарно повторяются?
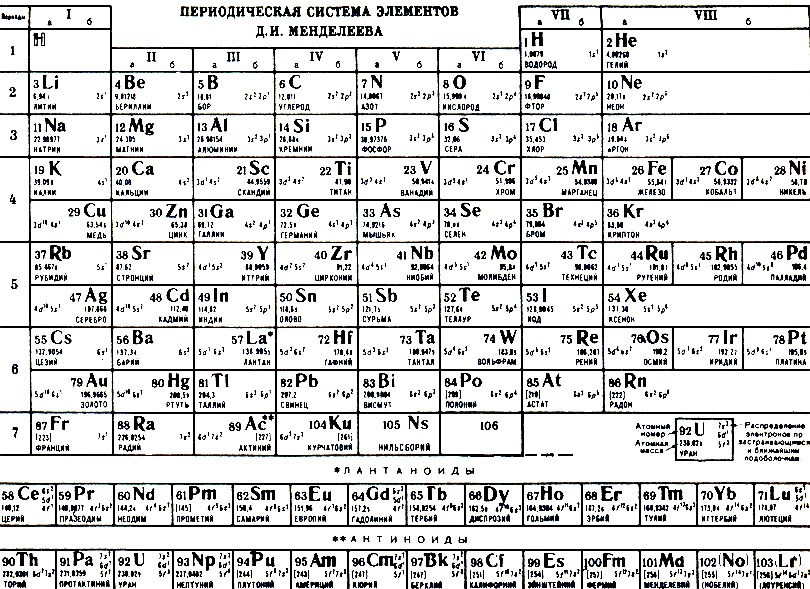
Мы определяли прежде период как совокупность элементов, начинающуюся щелочным металлом и завершающуюся инертным газом. Но теперь мы владеем языком электронных конфигураций и поэтому можем сказать, что атом любого щелочного металла (а также атом водорода) имеет такое строение внешней электронной оболочки:
Здесь n - главное квантовое число, оно же номер внешней электронной оболочки, оно же номер периода, ибо каждый период начинается элементом, в атоме которого появляется новая электронная оболочка.
Предоставим вам возможность дать определение периода элементов в периодической системе (имея в виду специфику первого периода, содержащего только s-элементы).
Если мы примем, что конфигурации внешних электронных оболочек атомов граничных (начального и конечного) элементов периода такие, как ns1 и nр6, то аналогично построенные периоды - второй и третий, четвертый и пятый, шестой и седьмой будут попарно повторяться и содержать одинаковое число элементов. Ибо другого распределения элементов по периодам быть не может.
А все это лишний раз подчеркивает, насколько гениальным "архитектором" был Д. И. Менделеев, который, ничего не зная о строении атомов, сумел создать удивительно стройную конструкцию таблицы элементов.
Настолько удачную конструкцию, что на основе выявления в ней закономерностей химического поведения элементов оказалось сравнительно просто проникнуть в тайну строения электронных оболочек.
Периодическая система на уроке химии.
Если подойти к вопросу строго и придирчиво, то о какой периодической системе мы только что вели разговор?
О периодической системе атомов: ведь мы обсуждали, как и в какой последовательности заполняются электронные оболочки и подоболочки и как периодически повторяются сходные электронные конфигурации. Элементы же с многообразием и своеобразием их свойств лишь подразумевались, но не присутствовали. В этом состоит одна из многих удивительных особенностей периодического закона. Чем больше мы о нем узнаем, тем более глубоким оказывается его содержание.
Познав закон строения атома, ученые объяснили причины периодичности изменения свойств химических элементов и структуру периодической системы. Но когда, опираясь на представления физики, мы пытались объяснить, почему тот или иной элемент обладает определенными свойствами, нам часто оказывалось недостаточно представлений о строении атома. Периодическая система элементов по своему внутреннему содержанию гораздо глубже и шире периодической системы атомов.
Вот перед нами первый химический элемент водород. Электронная структура его атома 1s. Казалось бы, его место в одной группе со щелочными металлами, в la-подгруппе. Но... свойства водорода таковы, что ему трудно подобрать одно вполне определенное место. Иногда его действительно помещают в первую группу, зачисляют в родственники к щелочным металлам. Как и у них, у водорода один электрон на внешней оболочке, и он может проявить положительную валентность, равную единице. И наконец, он способен вытеснять некоторые металлы из их солей. Но этим и ограничиваются свойства, родственные прочим элементам первой группы. Водород - неметалл, газ, а все остальные - типичные металлические элементы.
Зато у водорода много общего с галогенами - элементами седьмой группы. Как и у галогенов, молекулы водорода состоят из двух атомов. И галогены, и водород - типичные неметаллы. Подобно галогенам, водород может проявлять отрицательную валентность, вступая в соединения с металлами и образуя своеобразные вещества - металлические гидриды. Но и этого сходства слишком мало, чтобы считать водород родным братом галогенов.
Поэтому водород как бы объединяет в себе черты элементов и первой и седьмой групп. Такая "двуликость" водорода объясняется строением его атома. Любой элемент, отдавая валентные электроны, сохраняет в неприкосновенности одну или несколько предыдущих оболочек. Водород, расставаясь с единственным валентным электроном, предстает перед нами в виде "голого" атомного ядра - протона. Поэтому химия водорода - это до какой-то степени единственная в своем роде химия элементарной частицы. Первый элемент периодической системы и первое свидетельство того, насколько богаче оказываются его химические возможности по сравнению с тем, что можно предположить на основе строения его атома.
Когда-то Менделеев называл элементы второго и третьего периодов типическими. Он считал, что их химические особенности как бы определяют все последующее построение системы. И в самом деле: достаточно разобраться в поведении типических элементов, чтобы химическое лицо менделеевской таблицы во многом прояснилось.
Начинающие второй период литий и бериллий на "электронном" языке - 2s-элементы. Оба - металлы, литий легко отдает свой внешний электрон, бериллий - гораздо труднее. В атоме его соседа бора начинается заполнение 2р-подоболочки, а сам элемент оказывается неметаллом. Углерод, азот, кислород, фтор, неон - все они проявляют только неметаллические свойства.
Одно из основных правил химического взаимодействия гласит: атомы элемента могут отдавать электроны с внешних оболочек, либо, напротив, могут принимать их. Этот процесс потери - приобретения электронов имеет весьма определенную цель. Каждый атом как бы хочет стать таким, как атом ближайшего инертного газа, ибо атомы инертных газов весьма прочные образования. Для элементов второго периода таким "идеалом" служат гелий и неон.
Вот почему, например, кислород и фтор оказываются сильнейшими окислителями, не имеющими равных по химической агрессивности: до восьмиэлектронной внешней оболочки неона им остается добрать электронов совсем немного. И они с жадностью "отбирают" их у атомов других элементов.
Расскажем об одной удивительной особенности второго периода: три принадлежащих ему элемента - углерод, азот и кислород, вместе с водородом являются составными частями органической материи. Так сказать, своеобразными ответственными за жизнь на Земле. Почему? Вот, пожалуй, вопрос, поиски ответа на который потребуют участия не одного поколения будущих химиков.
В третьем периоде почти все так, как и во втором: 3s-элементы (натрий, магний) и 3р-элементы (алюминий - аргон). Почти все, да не все. Натрий химически куда активнее своего предшественника по группе лития: этим же отличается магний по сравнению с бериллием. Алюминий, в отличие от бора, типичный металл. Кремний - основа всех руд и минералов, "цемент" земной тверди - таит в себе некоторые прообразы металлических качеств. Фосфор и сера - твердые тела, а не газы, как их аналоги по группам азот и кислород. Хлор, как и фтор, - газ, тоже химический "агрессор", но менее яростный, чем фтор. Пожалуй, только аргон ничем внешне не отличается от неона.
Сопоставляя элементы второго и третьего периодов, что мы заметим? Вполне определенное, закономерное изменение свойств, по группам и по периодам, по вертикали и по горизонтали. Основные черты этих изменений сохраняются и дальше, в последующих периодах.
А именно:
в подгруппах щелочных и щелочноземельных металлов сверху вниз возрастает химическая активность (например, франций, если бы когда-нибудь удалось получить его в металлическом виде, оказался бы самым активным металлом), - такова, следовательно, особенность s-элементов;
у р-элементов сверху вниз возрастают металлические свойства (даже у галогенов, самый тяжелый из них астат во многом похож на металл), а слева направо (по периоду) свойства заметно изменяются при переходе от элемента к элементу. Например, углерод мало похож на бор, газообразный азот не имеет ничего общего с углеродом.
Вы обратили внимание, что пока речь идет лишь об s- и р-элементах? Эти элементы располагаются в главных, а-подгруппах периодической системы; у них имеется общее качество: в атомах по мере роста Z происходит заполнение внешней электронной оболочки (со значением главного квантового числа n, равного номеру периода).
Так как химические свойства элементов во многом зависят от числа внешних электронов, то поэтому-то при переходе от элемента к элементу свойства заметно меняются.
А какие же элементы относятся к б-подгруппам? Немного повременим с ответом. Сначала мы хотим рассказать, что инертные газы, оказывается, могут вступать в химические соединения.
Как инертные газы перестали быть инертными.
Ни из периодического закона, ни из теории строения атома не следует, что элементы нулевой группы, эти химические "ленивцы", вообще не способны вступать в реакции химического взаимодействия с другими элементами. Теория, родившаяся на основе опытов, указывала на исключительную прочность внешних электронных оболочек у этих "безразличных ко всему на свете" элементов: гелия, неона, аргона, криптона, ксенона и радона. Из теории вытекала их высокая химическая инертность.
Это полностью соответствует их свойствам. В обычных условиях они ни с чем не соединяются. В природе они находятся в свободном состоянии. Они даже не способны образовать свою собственную молекулу. Все это одноатомные газы. Их нормальное состояние - нулевая валентность.
Когда в 1900 г. Д. И. Менделеев и У. Рамзай встретились в Берлине, оба ученых пришли к убеждению, что в периодической системе нужно для этих бездеятельных элементов добавить еще одну, нулевую группу. Такое положение в менделеевской таблице для этих элементов долгое время было общепринято. Оно хорошо характеризует их свойства.
Однако химики никогда не теряли надежду преодолеть химическую "лень" инертных газов и заставить их вступать в химические превращения. Это оказалось чрезвычайно трудной задачей. Решение ее потребовало более 60 лет напряженной работы.
Попытки получить химические соединения инертных газов были предприняты сразу после, открытия аргона. В 1896 г., всего через два года после открытия аргона, было получено при очень высоком давлении первое соединение аргона с водой: АrН2O, однако оно не было соединением, где проявлялись химические связи. Но чтобы получить даже такие соединения для криптона и ксенона, химикам пришлось работать еще почти 30 лет.
В 1940 г. советскому химику Б. А. Никитину удалось заставить инертные газы вступать в реакцию с некоторыми органическими соединениями. И все же полученные им соединения нельзя было считать истинно химическими. Это были соединения без химической связи. В них атом инертного газа находился внутри органической молекулы и не мог ее покинуть. Такие соединения называются теперь клатратными соединениями.
Непрерывные неудачи создали общепринятое мнение о том, что инертные газы вообще не способны участвовать в химических реакциях. Но упорная борьба продолжалась. Развивая теорию химической связи, ученые-теоретики смогли с уверенностью предсказать возможность взаимодействия некоторых инертных газов с фтором.
И наконец в 1962 г. был достигнут замечательный успех. Канадскому химику Н. Бартлетту удалось получить первое настоящее соединение ксенона с платиной и фтором - XePtF6. Вскоре были получены соединения XeF6, XeF4 и XeF2. Это твердые кристаллические устойчивые вещества белого цвета.
Потом наступила очередь криптона. Оказалось, что и он может образовывать химические соединения. Вслед за криптоном и у радона были обнаружены химические свойства, причем радон, вероятно, должен быть самым активным среди инертных газов (правда, как редчайший радиоактивный элемент он доступен в очень малых количествах). Попытки вызвать на химическую откровенность аргон, неон и гелий успеха не имели, и теория химической связи весьма скептически смотрит на возможность получения их соединений.
В настоящее время известно несколько десятков химических соединений - фторидов, хлоридов, окислов, кислот и солей - ксенона, криптона и радона. Недавно получено соединение ксенона с азотом. А тем самым пресловутая идея о незыблемой прочности внешней восьмиэлектронной оболочки Оказалась основательно поколебленной. Теперь прилагательное "инертные" по отношению к криптону, ксенону и радону употребляется лишь по традиции. Поскольку же половина инертных газов обнаружила необыкновенную химическую деловитость, то в последнее время в периодической системе нулевую группу стали заменять восьмой, т. е. инертные газы составляют теперь VIIIa-под-группу.
А какие элементы входят в б-подгруппы?
В побочные, или б-подгруппу входят те элементы, в атомах которых происходит построение оболочек, ранее остававшихся недостроенными. Именно поэтому, как вы легко сообразите сами, в первом, втором и третьем периодах содержатся лишь элементы, входящие в главные подгруппы. Элементы побочных подгрупп появляются в четвертом периоде, и первым таким элементом оказывается скандий (3d-элемент).
У всех d-элементов (за редкими исключениями, которые никак почти не сказываются на свойствах) число внешних s-электронов постоянно и равно двум. Поэтому-то, во-первых, все d-элементы - металлы. Их нередко называют переходными, так как действительно они представляют в больших периодах переход от s- к р-элементам.
Во-вторых, при переходе от одного d-элемента к другому мы не наблюдаем столь же резкого изменения свойств, как в случае р-элементов. Скорее мы видим плавное изменение. Иногда оно становится настолько плавным, что соседние элементы оказываются весьма похожими.
И тогда-то обнаруживается: симметричность структуры периодической системы нарушается, потому что нужно разместить эти "весьма похожие" элементы, да еще и наиболее логичным способом. Так в системе появляется пристройка, которая соответствует своеобразной группе - восьмой. Входящие в нее элементы группируются по три в каждом большом периоде таблицы. Эти группировки называются триадами.
Элементы триад очень сходны между собой. Даже названия некоторых из них объясняются именно таким сходством. В средние века рудокопы находили иногда загадочные руды, похожие на железные, из которых никак не удавалось выплавить железо. Озадаченные рудокопы наивно думали, что над ними зло шутят горные духи - карлики кобольды и старый черт Ник. Отсюда и имена двух элементов первой триады: кобальт и никель.
Элементы двух других триад еще более похожи друг на друга; их даже объединяют общим названием: платиновые металлы. И все они встречаются в природе почти исключительно в самородном металлическом состоянии. Казалось бы, максимальная валентность элементов в триадах должна равняться восьми. Ведь в других группах подавляющее большинство элементов способно проявлять валентность, равную номеру группы. Но таких "высот" достигают лишь рутений и осмий: им удается образовывать окислы RuO4 и OsO4. Получается, что номер группы носит чисто формальный характер. И некоторые химики не без основания указывали на это, как на слабое место периодической системы.
У железа, кобальта и никеля происходит достройка предыдущей электронной оболочки (М-оболочки) d-электронами. И эта оболочка уже близка к завершению. Точно такую же картину мы видим и в атомах платиновых металлов.
А раз предыдущая оболочка вот-вот должна заполниться до нужной емкости, то атому из восьмой группы становится невыгодным отдавать с нее много электронов. Поэтому восьмивалентное состояние - большая редкость для элементов триад.
Платиновые металлы вообще неохотно позволяют вовлекать себя в химические реакции даже самым яростным химическим агрессорам.
Теперь элементы триад стали включать в побочную, VIII б-подгруппу, хотя и не все химики с этим согласны.
Загадка редкоземельных элементов.
Но ведь мы с вами знаем, что еще есть и f-элементы. Лишь беглый взгляд на периодическую систему может вызвать удивление: для 4f-элементов словно не нашлось места в системе. Они в количестве четырнадцати - от церия до лютеция - вынесены под таблицу.
История так называемых редкоземельных элементов (под этим именем фигурируют лантан и 14 лантаноидов- 4f-элементов) одна из самых сложных и запутанных страниц истории периодического закона.
Сколько редкоземельных элементов должно помещаться в одной клетке периодической системы?
Для Менделеева такой вопрос был просто неуместен: одну клетку в таблице может занимать только один элемент.
Многие известные химики, среди них и сам Менделеев, долго бились над размещением редкоземельных элементов в периодической системе: пытались поместить, например, церий в четвертой группе, празеодим в пятой, для неодима искали место в шестой.
Но эти необыкновенные элементы нарушали самую основу структуры периодической системы. При любых попытках разместить их в таблице периодическая повторяемость свойств не соблюдалась. В побочных подгруппах, куда они попадали, должны быть сходные элементы. Церий же не имел ничего общего с цирконием, празеодим - с ниабием, и неодим совершенно не был похож на молибден.
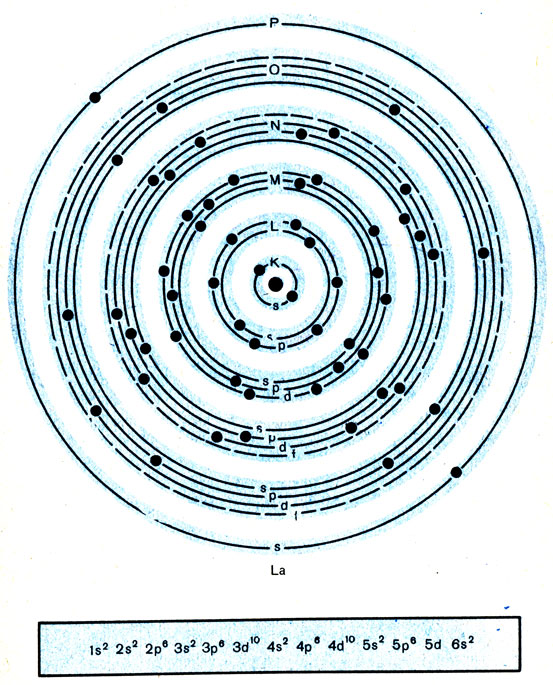
Рекомендуем внимательно изучить эту упрощенную схему строения сложного атома лантана. Обратите внимание: на всех энергетических уровнях обязательно по два s-электрона, по шесть р-электронов. В оболочках М и N кроме этих электронов есть еще по десять d-электронов. Заметьте, что подоболочка, где должны быть f-электроны, пустая, на ней ни одного электрона нет. Затем у лантана только один 52-электрон и, наконец, еще два 6s-электрона. Всего у лантана, как это и должно быть, 57 электронов. Он занимает клетку 57
Зато по мере того, как изучались их химические свойства, становилось все более ясным, что эти элементы сходны друг с другом, как братья-близнецы. Они настолько химически подобны, что и различить, и разделить их чрезвычайно трудно. Но все они, бесспорно, разные элементы. В этом химики не сомневались.
Друг Менделеева - чешский химик Б. Браунер предложил самое простое решение: поместить все эти элементы в одну клетку таблицы. Но, по существу, это только увеличило принципиальную трудность проблемы, не разрешив ее.
Если одно место могут занимать несколько различных элементов, то, во-первых, нарушается основной принцип периодической системы и, во-вторых, становится совершенно невозможно предвидеть и предсказать, сколько же элементов можно найти в природе, сколько их вообще может существовать. Химики всего мира разыскивали их очень усердно и более чем успешно. За короткий период, примерно за 30 лет, было открыто почти сто (!) редкоземельных элементов, и подавляющее большинство открытий оказалось ошибочным. Все попытки найти разумное решение проблемы редких земель были безуспешными.
Только квантовая теория строения атома помогла решить окончательно эту большую загадку химии.
Детальное изучение спектральных характеристик у редкоземельных элементов показало, что строение их атомов очень своеобразно. Все они внешне совершенно сходны между собой. Их наружные электронные оболочки, за некоторыми исключениями, о которых мы скажем дальше, построены совершенно одинаково.
У всех них в самой наружной р-оболочке по два s-электрона, поэтому все они металлы. Глубже расположенная 5d-подоболочка, принадлежащая к О-оболочке, в атомах редкоземельных элементов еще не заполнена - в ней всего лишь один электрон, который тоже может принимать участие в химических превращениях, да и то у церия, гадолиния и лютеция. Определение порядкового номера установило, сколько же всего редкоземельных элементов, а изучение спектров помогло выяснить строение их атомов. Оказалось, что они отличаются друг от друга числом 4f-электронов на оставшейся незаполненной, глубоко скрытой в недрах атома N-оболочке. Эти электроны защищены снаружи броней устойчивой оболочки 5s2, 5р6. Они почти совершенно блокированы и не могут проявить, себя в химических свойствах.
Все редкоземельные элементы трехвалентны. Почему? Ответить не так-то просто. Только у La, Се, Gd и Lu три валентных электрона налицо. А у остальных - лишь два 6s-электрона готовы принять участие в химических связях. Откуда же берется третий? Ведь 4f-подоболочка глубоко запрятана в недрах атома... Вот задача, до конца не решенная...
Зная теперь законы построения внешних электронных оболочек атома, любой из вас, будущих химиков, сможет сам решить проблему, над которой химики прошлого бились многие десятилетия: сколько редкоземельных элементов существует в природе?
Очевидно, ровно столько, сколько их соответствует постепенному заполнению всех орбит с этими электронами. Обозначение f заменяет квантовое число l=3. Мы уже знаем, что таких орбит может быть 2*3 + 1 = 7. А на каждой может быть не больше двух электронов. Следовательно, таких элементов в природе может быть четырнадцать. Всего же в природе должно существовать ровно пятнадцать элементов-близнецов, считая и лантан, свойствами близкий к лантаноидам. Столько их в действительности и оказалось, начиная с 57-го - лантана до 71-го - лютеция. Правда, в природе все-таки оказался пробел: 61-й элемент нашли совсем недавно. Ученым пришлось получить (синтезировать) его искусственно. Этот элемент назвали прометием.
Итак, можно ли сказать, что в одной клетке периодической системы размещаются пятнадцать элементов? Этот вопрос обсуждается часто и в наши дни. Периодический закон Менделеева - это всеобщий закон природы. В естественной системе элементов каждый элемент занимает одно место и, следовательно, в таблице каждый элемент - одну клетку. Менделеев придал своей таблице самую простую и удобную форму. Изображать же ее можно по-разному. Можно просто помнить, что одна клетка между барием и гафнием условно заменяет сразу пятнадцать клеток. Но можно менделеевскую таблицу начертить так, чтобы все длинные периоды оказались развернутыми. Периодический закон от этого не изменится.
Так ли все просто в теории периодической системы?
Порой с оговорками, но с помощью теории строения электронных оболочек можно объяснить многие закономерности и особенности химического поведения элементов. Согласитесь, что эта теория оказывается очень удобным рабочим инструментом и для тех, кто только начал изучать химию, и для тех, кто уже работает в научно-исследовательском институте или заводской лаборатории.
Ее, эту теорию, ученые называют формальной теорией периодической системы.
Формальная? Ведь этому прилагательному противостоит другое: фактическая. Следовательно, в теории есть что-то такое, что не удовлетворяет ученых, что не совсем соответствует действительному положению вещей? Да, это так. Представление об атоме как о системе, состоящей из ядра и вращающихся вокруг него по определенным орбитам электронов, не соответствует истине. Все гораздо сложнее...
Атом квантовомеханический.
Здесь вам нередко придется верить нам на слово. Потому что те проблемы, о которых мы будем рассказывать, требуют очень большой подготовки.
Стройность и изящество атомной теории Бора покоряли воображение, но физики видели в ней не только достоинства, но и существенные изъяны. Они, например, справедливо замечали, что боровская теория наполовину использует новые (квантовые) представления, наполовину старые (взятые из классической механики). Один ученый даже остроумно пошутил: "В теории Бора мы как бы должны по понедельникам, средам и пятницам пользоваться классическими законами, а по вторникам, четвергам и субботам - квантовыми".
Когда Бор строил схему последовательного заполнения электронных оболочек и подоболочек, то он опирался, во-первых, на периодическую систему элементов и накопленные знания об их химических свойствах, а во-вторых, на результаты исследований атомных спектров. Схема заполнения как бы строилась в соответствии с уже готовым каркасом - менделеевской таблицей элементов, а не была плодом какой-либо фундаментальной физической теории.
И это тоже не удовлетворяло ученых.
Но будем объективными. Более полувека прошло с того времени, как Бор объяснил причину периодического изменения свойств элементов, а ученые и сейчас пользуются,, и в дальнейшем будут пользоваться его представлениями. Потому что они чрезвычайно наглядны. Это хоть и приближенная, но прекрасно работающая модель действительного положения вещей.
В середине 20-х годов французский физик Л. де Бройль высказал смелую идею: все материальные частицы (в том числе и электроны) обладают не только материальными, но и волновыми свойствами. Вскоре удалось показать, что электроны, подобно световым волнам, могут огибать препятствия.
Раз электрон - волна, то его движение в атоме может быть описано с помощью волнового уравнения. Такое уравнение вывел в 1926 г. австрийский физик Э. Шрёдингер. Математики называют его дифференциальным уравнением второго порядка в частных производных. Для физиков же это основное уравнение квантовой механики.
Вот как выглядит уравнение Шрёдингера:
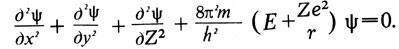
Но кое-кто из вас, может, увидит в этом уравнении знакомые обозначения - m, e, r, Z, которыми не раз приходилось пользоваться на школьных уроках физики:
m - это, конечно, масса, в данном случае масса электрона;
r - расстояние электрона от ядра;
е - заряд электрона;
Е - полная энергия электрона, равная сумме кинетической и потенциальной энергии;
Z- порядковый номер атома (для атома водорода равен l).
Конечно, вам знакомо и обозначение π, а что касается h, то эта величина - основная в квантовой теории и называется квант действия.
Буквами х, у, z обозначаются координаты электрона.
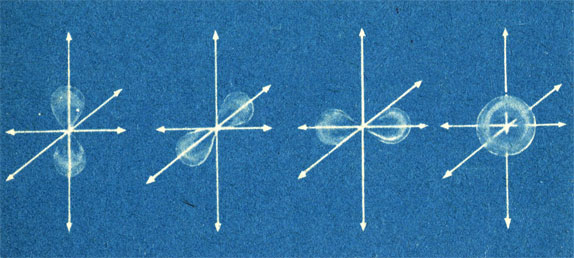
Схематическое изображение s- и р-орбиталей
Как видите, пока нет ничего необычного. Необычной оказывается величина Ψ, которая носит название волновой функции.
Она не измеряется ни в граммах, ни в сантиметрах, ни в секундах. Это абстрактная отвлеченная величина, которая характеризует... степень вероятности.
Степень вероятности того, что электрон находится в определенном месте пространства вокруг ядра. Если ψ = 1, то, значит, электрон действительно должен находиться в этом самом месте; если же ψ = 0, то электрона там нет и в помине.
Вот это-то представление о вероятности нахождения электрона центральное в квантовой механике. А величина Ψ (пси)- функции (точнее говоря, квадрат ее величины - Ψ2) выражает вероятность пребывания электрона в той или другой точке пространства.
Так как же выглядит атом квантовомеханический?
Прежде всего в нем нет определенных электронных орбит, столь четко очерченных в боровской модели атома. Электрон словно бы размазан в пространстве в виде некоторого облака. Но плотность этого облака различна: как говорится, где густо, а где и пусто. Большей плотности облака соответствует большая вероятность нахождения электрона.
Все это не очень наглядно, но, право же, мы нарисовали картину, по возможности более точно передающую основную идею квантовомеханического атома. Добавим, самого простого атома - атома водорода с одним электроном. Когда электронов два или больше, все существенно усложняется, так как нужно учитывать явление взаимодействия электронов (электронных облаков).
Прочтя все это, вы можете резонно заметить: пусть действительно атом устроен так, как его описывает квантовая механика. Но, собственно говоря, каким же образом он связан с реальными свойствами химических элементов?
Оказывается, связан. Вся современная теория химической связи опирается на представление о квантовомеханическом атоме. Как именно - на этом мы не будем останавливаться. Обратим внимание на другое обстоятельство, на то, что от отвлеченной квантовомеханической модели можно перейти к уже знакомой нам, такой наглядной и зримой модели атома Бора.
Для этого нужно решить уравнение Шрёдингера. Как его решить - это объяснить непросто. Сообщим лишь конечный результат: оказывается, что волновая функция связана с тремя различными величинами, которые могут принимать только целочисленные значения. Более того, последовательность изменения этих величин такова, что они не могут быть ни чем иным, как квантовыми числами. Главным, орбитальным и магнитным.
Следовательно, наши знакомые n, l и ml получаются на основе весьма солидной физической теории - квантовой механики. А ведь они были введены когда-то специально для объяснения спектров различных атомов.
Затем они весьма органично перекочевали в боровскую модель атома. И вот теперь выясняется, что квантовые числа получаются в результате решения важнейшего уравнения квантовой механики. Такова научная логика - к ней не подкопается далее самый суровый скептик.
Но ведь все это значит, что решение уравнения Шрёдингера в конечном счете приводит к выводу последовательности заполнения электронных оболочек и подоболочек атомов. К строгому физическому выводу. В этом главное достоинство атома квантовомеханического перед атомом Бора. И привычные для планетарного атома понятия молено пересмотреть под углом зрения квантовой механики.
Например, можно считать, что "орбита" - это некоторая совокупность вероятных положений данного электрона в атоме. Она соответствует определенной волновой функции.
Вместо термина "орбита" в современной атомной физике и химии употребляется термин "орбиталь", или "атомная орбиталь". Например, s-орбитали, р-орбитали, d-орбитали, f-орбитали. Они отвечают значениям l = 0,1,2,3...
Итак, уравнение Шрёдингера - это словно волшебная палочка, которая устраняет все недочеты, содержавшиеся в формальной теории периодической системы. Превращает "формальное" в "фактическое".
В идеале это так, а в действительности - далеко не так. Потому что уравнение имеет точное решение для атома водорода, самого простейшего из атомов, - и только для него.
Для атома гелия и последующих точно решить уравнение Шрёдингера нельзя, поскольку прибавляются силы взаимодействия между электронами. А учесть их, правильно оценить их влияние на конечный результат - математическая задача невообразимой сложности.
Человеческим способностям она недоступна; только быстродействующие электронно-вычислительные машины, проводящие сотни тысяч операций в секунду, могут справиться с ней. Да и то лишь при условии, что программа для вычислений разрабатывается с многочисленными упрощениями и приближениями.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'